펩트론이 MUC1에 특이적으로 결합하는 항체 및 그의 용도에 관한 특허출원에 대한 등록을 허가받았다.
기타 경영사항(특허권 취득)(자율공시)
| 1. 특허명칭 | MUC1에 특이적으로 결합하는 항체 및 그의 용도 (Antibody specifically binding to MUC1 and Use thereof) |
| 2. 특허 주요내용 | 본 특허는 MUC1(Mucin 1)에 특이적으로 결합하는 항-MUC1 항체 및 그 용도에 관한 것으로, 더욱 상세하게는 항-MUC1 항체 또는 이의 항원 결합 단편, 상기 항체 또는 이의 항원 결합 단편을 포함하는 항체-약물 접합체 또는 이중특이 항체, 이를 포함하는 암의 예방 또는 치료용 약학 조성물 및 상기 항체 또는 이의 항원 결합 단편을 코딩하는 핵산, 상기 핵산을 포함하는 벡터 및 숙주세포, 이를 이용한 항-MUC1 항체 또는 이의 항원 결합 단편의 제조 방법에 관한 것임 |
| 3. 특허권자 | 주식회사 펩트론 |
| 4. 특허취득일자 | 2020-06-22 |
| 5. 특허 활용계획 | - 본 특허 기술인 항-MUC1 항체 및 항체-약물 접합체는 MUC1 관련 질병인 암, 특히 유방암, 췌장암, 전립선암, 폐암, 갑상선암, 위암, 난소암, 대장암, 간암, 담낭암, 신장암, 자궁경부암, 또는 방광암의 치료에 유용하게 적용할 수 있는 약학 조성물임 - 본 특허를 바탕으로 표적항암제 및 면역항암제 개발을 진행하고자 함. |
| 6. 확인일자 | 2020-06-23 |
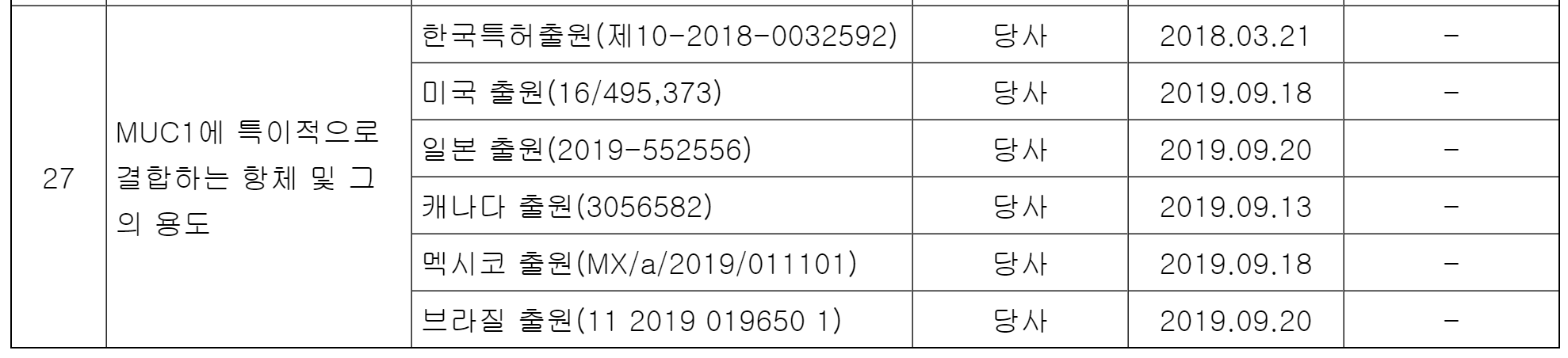
| 7. 기타 투자판단에 참고할 사항 | - 특허등록국가: 대한민국(출원번호: 10-2018-0032592) - 미국 외 11개국에 해외 개별국 특허 출원 완료 - 상기 특허취득일자는 특허청 접수일임 - 상기 확인일자는 특허등록 대리인의 특허 등록료 납부서 수령일임 |
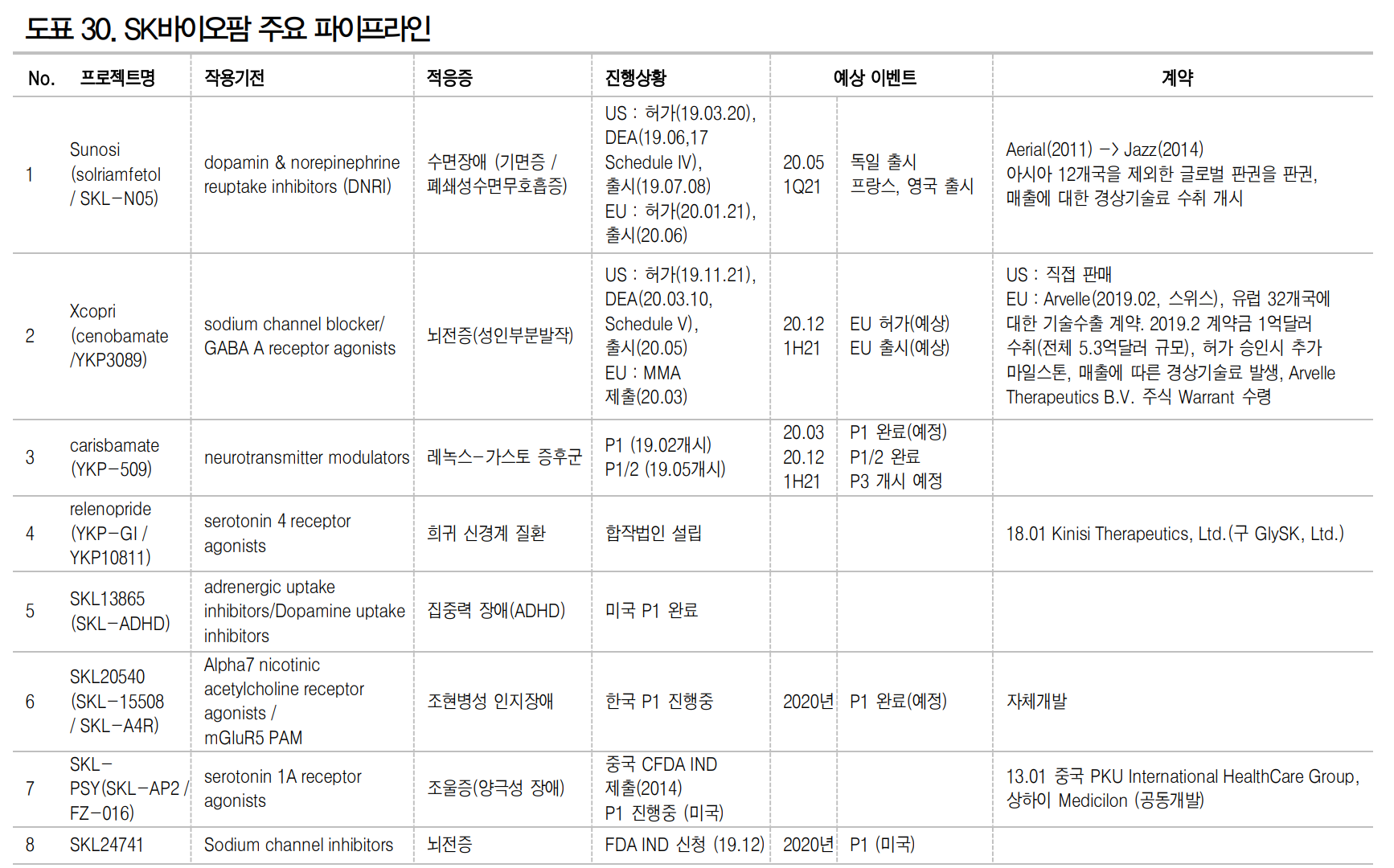
이 특허는 펩트론의 파이프라인 중 PAb001에 관한 것으로 현재 기술이전 추진 중이다. PAb001은 세포 표면 당단백질인 뮤신1(MUC1)을 표적으로 하는 항암제이다. PAb001은 유방암, 자궁암, 췌장암, 대장암, 신장암, 급성골수성백혈병 등 12가지 암에 대해서 효과를 적용할 수 있는 물질이다.
특허등록에 관한 공시로 시간외에서 상한가를 기록하였다. 특허등록허가로 인해 기술에 대한 경쟁력을 시장에 확인시켜줌으로써 기술이전에 대한 시장의 기대감이 반영된 것으로 보인다.

한국을 제외한 다른 나라의 PAb001에 관한 특허 진행사항은 미국, 일본, 캐나다, 멕시코, 브라질은 출원 중이다. 한국보다 1년 늦게 출원하엿으므로 등록은 최소한 1년 이상이 더 걸릴 것으로 예상된다.
'주식 > 기업' 카테고리의 다른 글
| #크래프톤, IPO가 기다려지는 새로운 게임강자 (0) | 2020.07.06 |
|---|---|
| #대봉엘에스, 삭센다를 대체할 새로운 비만치료제 기술이전 추진 (0) | 2020.06.28 |
| #톱텍, 에어퀸 비말마스크 식약처 허가 완료 (0) | 2020.06.23 |
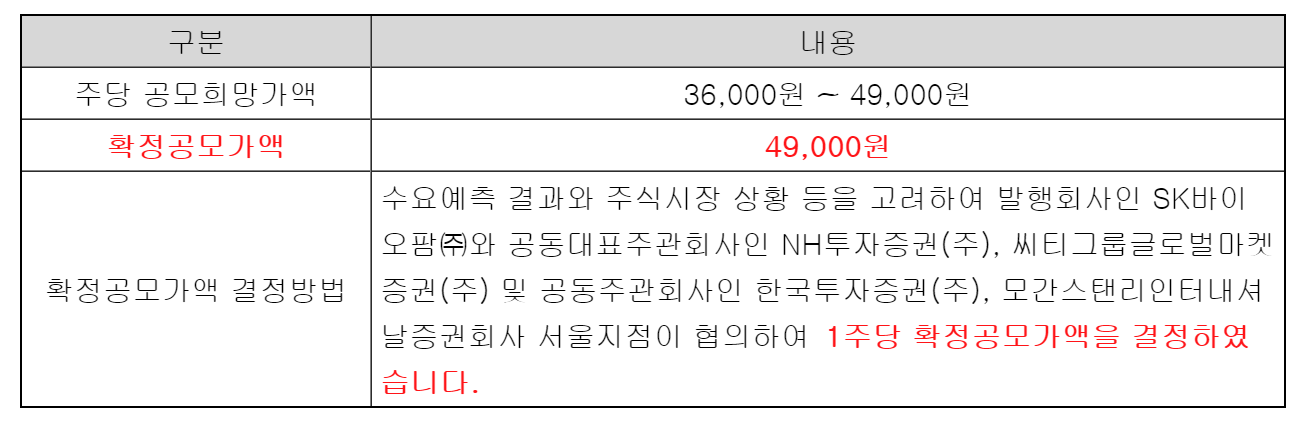
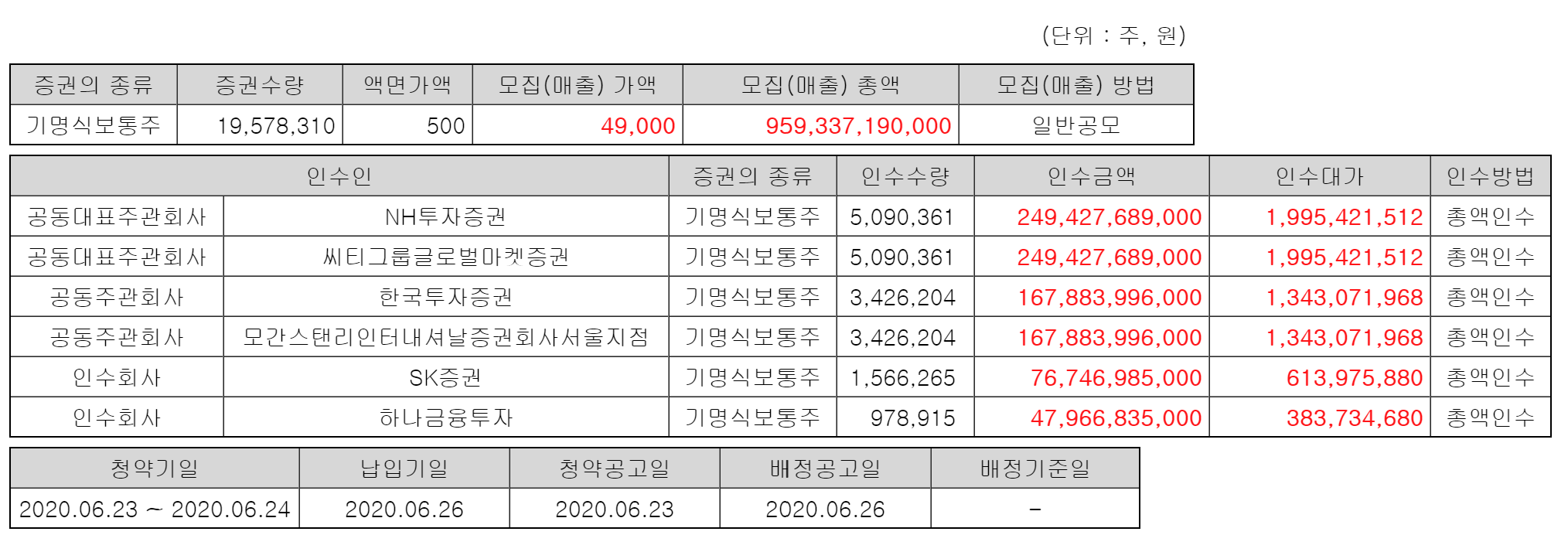
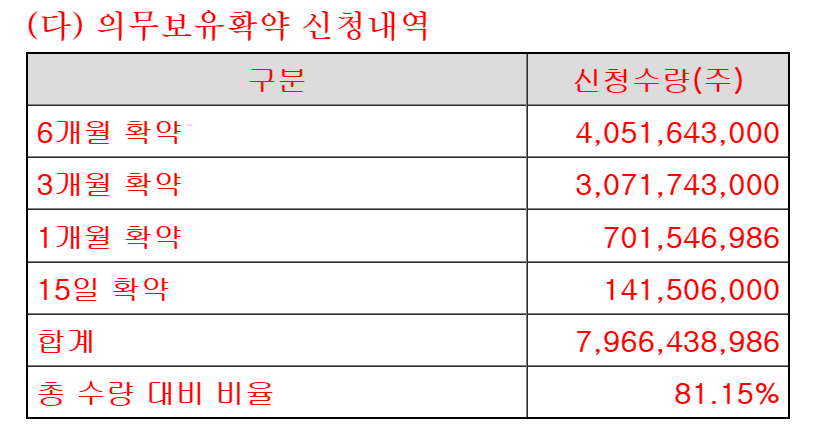
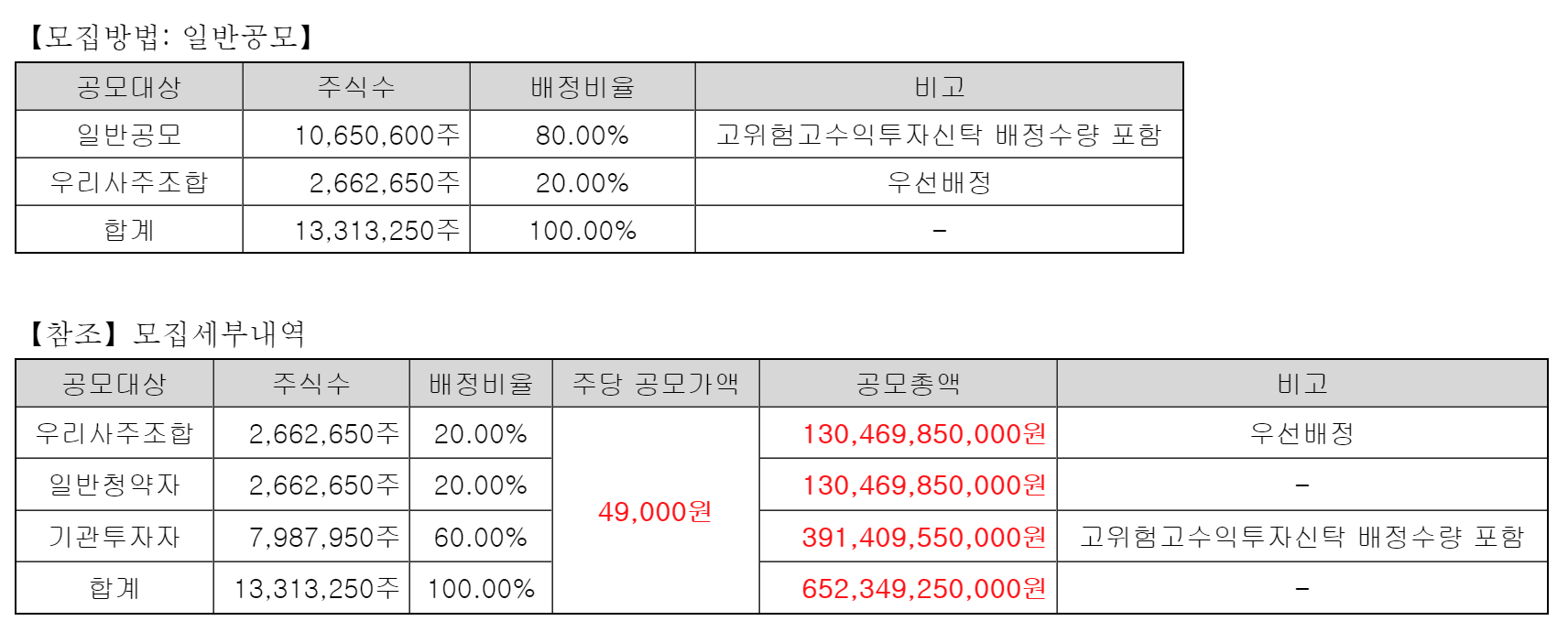
| #SK바이오팜, 공모가 49,000원 수요예측 835.66대 1 (0) | 2020.06.19 |
| #SK바이오팜, 파이프라인 체크(FDA 승인받은 수노시와 엑스코프리) (0) | 2020.06.18 |