현대차증권에서 나온 알테오젠 리포트를 읽어보자.
키트루다SC 임상1상에 3주간 저용량 투약군이 추가되었다.
기존에는 6주간 고용량 투약군이 키트루다SC with ALT-B4이고, 3주간 투약군은 머크 자체 키트루다SC로 별개의 임상을 진행하고 있었다.
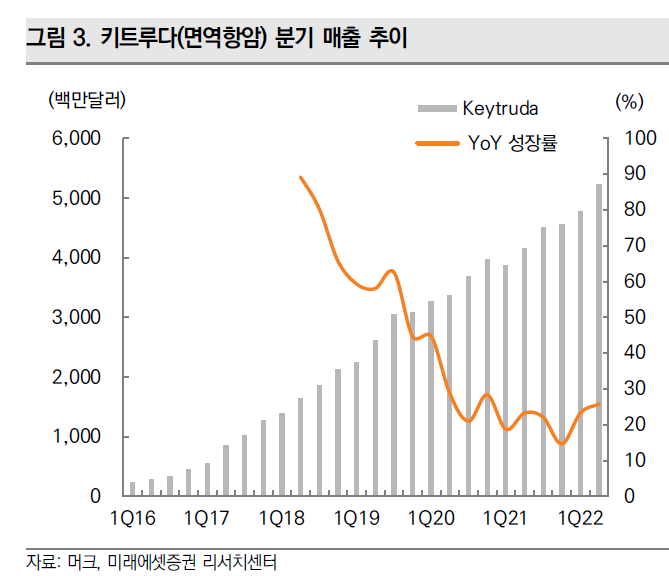
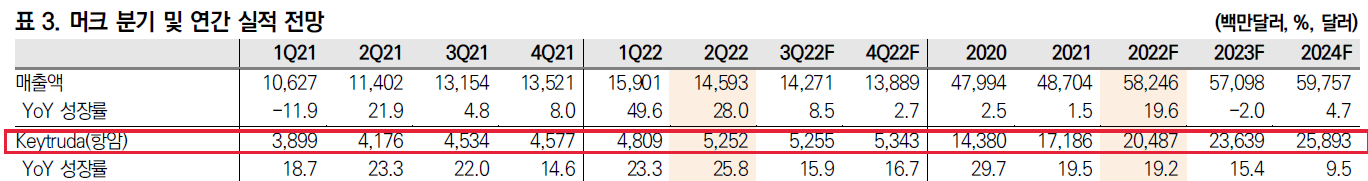
그 당시 해석은 키트루다 매출 대부분은 고용량이기 때문에 저용량 매출이 차지하는 비율이 크지 않는다는 것이었다.
하지만 이번에 저용량 투약군도 추가됨으로써, ALT-B4가 머크의 키트루다에게 더 필요하다는 것을 확인시켜주었다.
주가와는 반대로 시간이 갈수록 머크에게 알테오젠이 중요해지고 있다.

'주식 > 알테오젠' 카테고리의 다른 글
| 알테오젠, 실적 턴어라운드 기업으로도 좋다! (0) | 2023.03.26 |
|---|---|
| 알테오젠, 오리지널 신약을 지키려면 이젠 ALT-B4가 해답이다! (0) | 2023.03.26 |
| 알테오젠, 신규 이사선임으로 회계 강화 (0) | 2023.03.17 |
| 알테오젠, 키트루다SC 특허는 2036년까지 보호가능! (0) | 2023.03.10 |
| 알테오젠, 최근 주가하락 원인은 키트루다 특허 연장 조치 반대 이슈 (0) | 2023.03.03 |