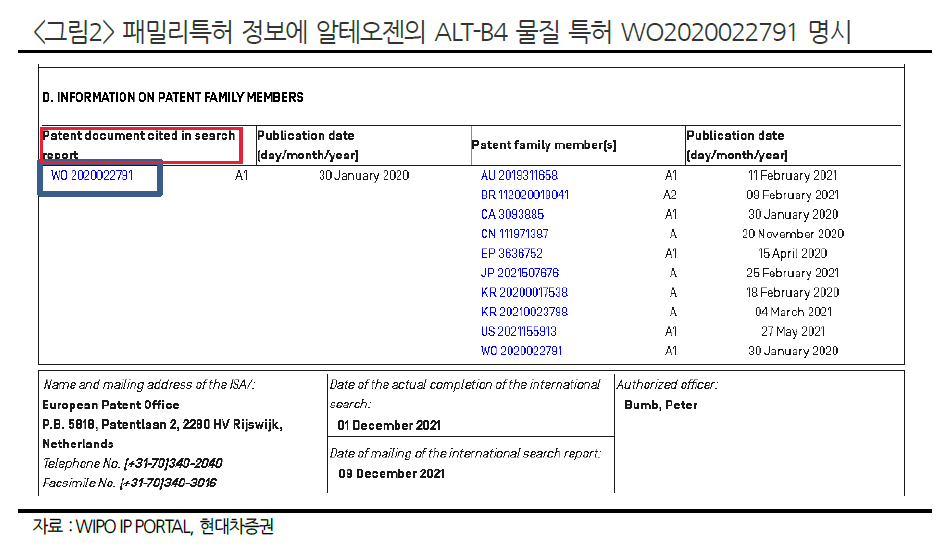
황반변성 시장은 아일리아가 독주하고 있다. 그 이유로 아일리아 특허 만료를 앞두고 여러 기업들이 앞다투어 바이오시밀러 개발하고 있다.
아일리아 물질 특허는 2024년에 만료되지만, 제형특허는 2027년에 만료된다.
| 특허별 만료일 | 중국, 한국, 일본 등 아시아 | 유럽 | 미국 |
| 아일리아 물질특허 (성분 자체에 관한 특허) |
2024년 | 2025년 | 2027년 |
| 아일리아 제형특허 (물질을 안정화하는데 추가로 들어가는 완충제에 대한 특허) |
2027년 | 2030년 | 2027년 |
제형특허가 없으면 아일리아 바이오시밀러를 개발완료했더라도 2027년까지 출시할 수가 없다. 제형특허가 확보된 업체는 암젠, 삼천당제약, 알테오젠 3개업체로 현재까지는 밝혀져있다.
알테오젠은 제법특허도 유럽과 미국에서 출원과정에 있다. 유럽특허는 별문제 없으면 등록이 될 것으로 예상하고 있다.
제법특허는 의약품을 제조하는 방법에 관한 특허이기 때문에 알테오젠의 제법특허가 등록되면 오리지널사의 방법과 아알테오젠 제조 방법으로는 아일리아 바이오시밀러를 만들 수 없게 된다. 다른 방법으로 만들 수야있겠지만 경제성이 떨어지기 때문에 제품 경쟁력이 저하된다.
여기에 최근에 PFS특허까지 출원했다.
오리지널사는 유리, 알테오젠은 플라스틱이다. 유리와 플라스틱 이외에 의약품을 안전하게 담을 용기가 있을까?
이것이 알테오젠이 노리는 특허장벽이며, 알테오젠의 ALT-L9의 가치다.
| 업체명 | 프로젝트명 | 제형특허 | 제법특허 | PFS특허 | |
| 밀란&모텐타마타슈티컬 | M-710 | 임상3상(2018~) | |||
| 암젠 | ABP-938 | 임상3상(2020년 3월~) | O | O | |
| 포마이콘 | FYB-203 | 임상3상(2020년 5월~) | |||
셀트리온 |
CT-P42 | 임상3상 | |||
삼성바이오에피스 |
SB15 | 임상3상 | |||
삼천당제약 |
SCD411 | 임상3상 | 일본, 유럽 | 한국 | |
| 알테오젠 | ALT-L9 | 임상3상(2022년 3월 예정~) | 미국, 일본 | 한국, 일본, 호주, 러시아 | 유리 |
ALT-L9의 성공에 새로운 복병은 로슈가 최근에 FDA승인받은 새로운 황반변성치료제인 바비스모(Vabysmo)다.
바비스모는 황반병성 치료제로는 최초로 기존 VEGF와 더불어 Ang-2(angiopoietin-2)와 결합하여 억제하는 이중항체 치료제다.
기존 황반병성 치료제는 아일리아, 루센티스, 비오뷰가 있었는데, 새로운 경쟁약물이 나타난 것이다.
바비스모는 아일리아에 비해 주사횟수가 짧다. 안구에 직접 주사하는 안구주사의 특징상 주사횟수가 짧은 것은 매우 큰 장점이다. 아일리아는 1년에 최소 4회 이상 시술받아야 하지만, 바비스모는 1년에 최소 3회다.
아일리아의 성공 또한 루센티스(1년에 최소 6회)보다 주사횟수가 짧아서 성공했다고 볼 수도 있기 때문에 바비스모의 앞으로의 횡보를 주목해야 한다.

https://pharm.edaily.co.kr/news/read?newsId=01371046632297760&mediaCodeNo=257
박순재 알테오젠 대표 “3단 특허 확보, 아일리아 바이오시밀러 시장 장악 확신”
“2025년 물질특허가 만료되는 ‘아일리아’(성분명 애플리버셉트) 관련 바이오시밀러 개발사 중 제형특허와 제법특허에 이어 플라스틱 기반 프리필드실린지(PFS, 사전 충전 주사)특허까지 확보
pharm.edaily.co.kr
'주식 > 알테오젠' 카테고리의 다른 글
| 알테오젠, ALT-B4 L/O 한발짝 전진! (0) | 2022.06.17 |
|---|---|
| 알테오젠, 바이오USA에서 ALT-B4기술수출 논의 예정! (0) | 2022.06.09 |
| 알테오젠, 머크로 임상3상 시료 공급 완료 (0) | 2022.04.26 |
| 알테오젠, 머크 특허 명세서를 읽어보면 알테오젠이 보인다! (2) | 2022.04.25 |
| 알테오젠, 알테오젠 특허는 머크 특허의 패밀리가 아니다 (4) | 2022.04.24 |