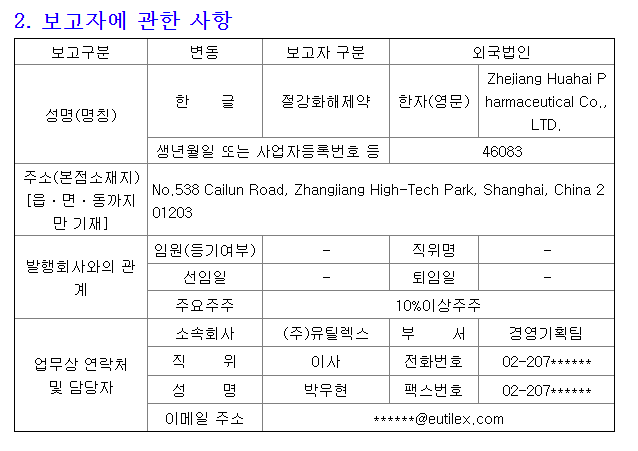
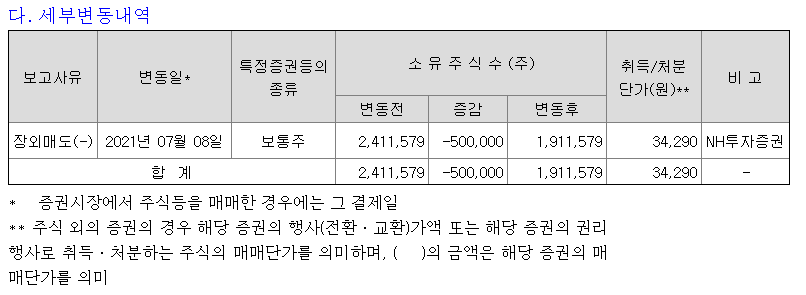
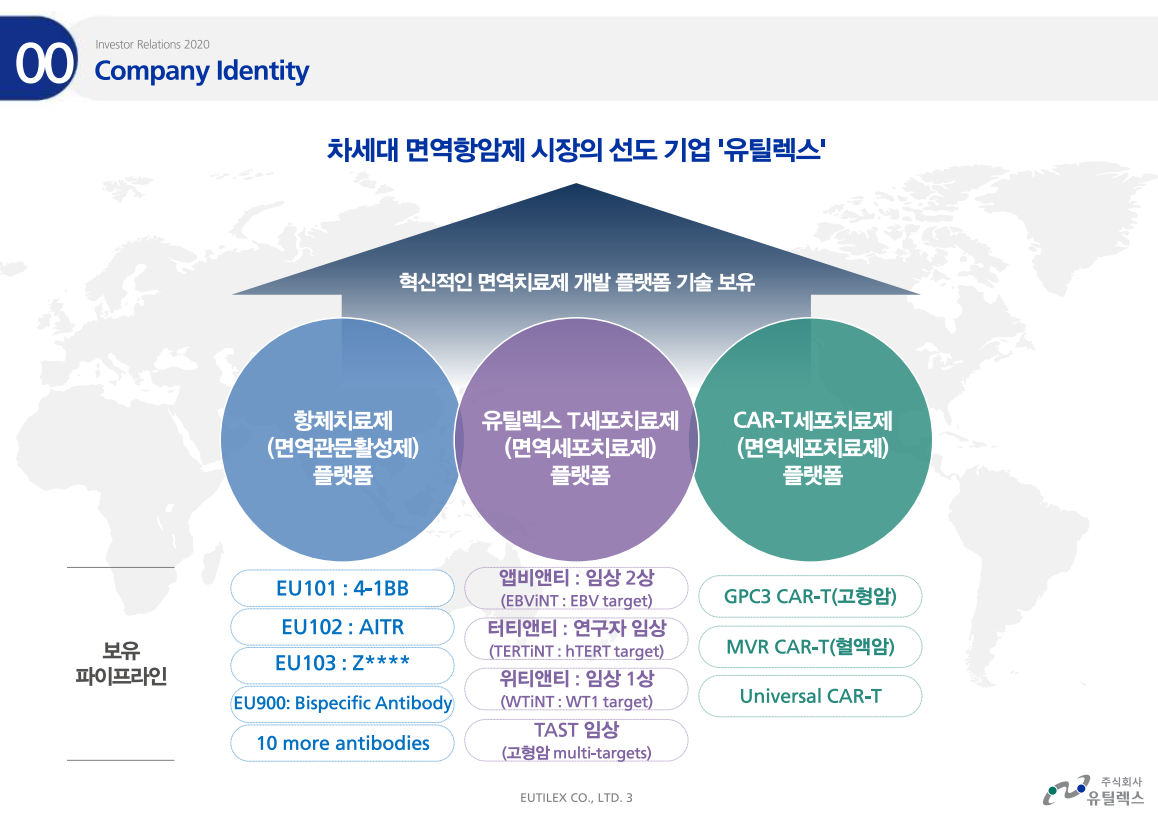
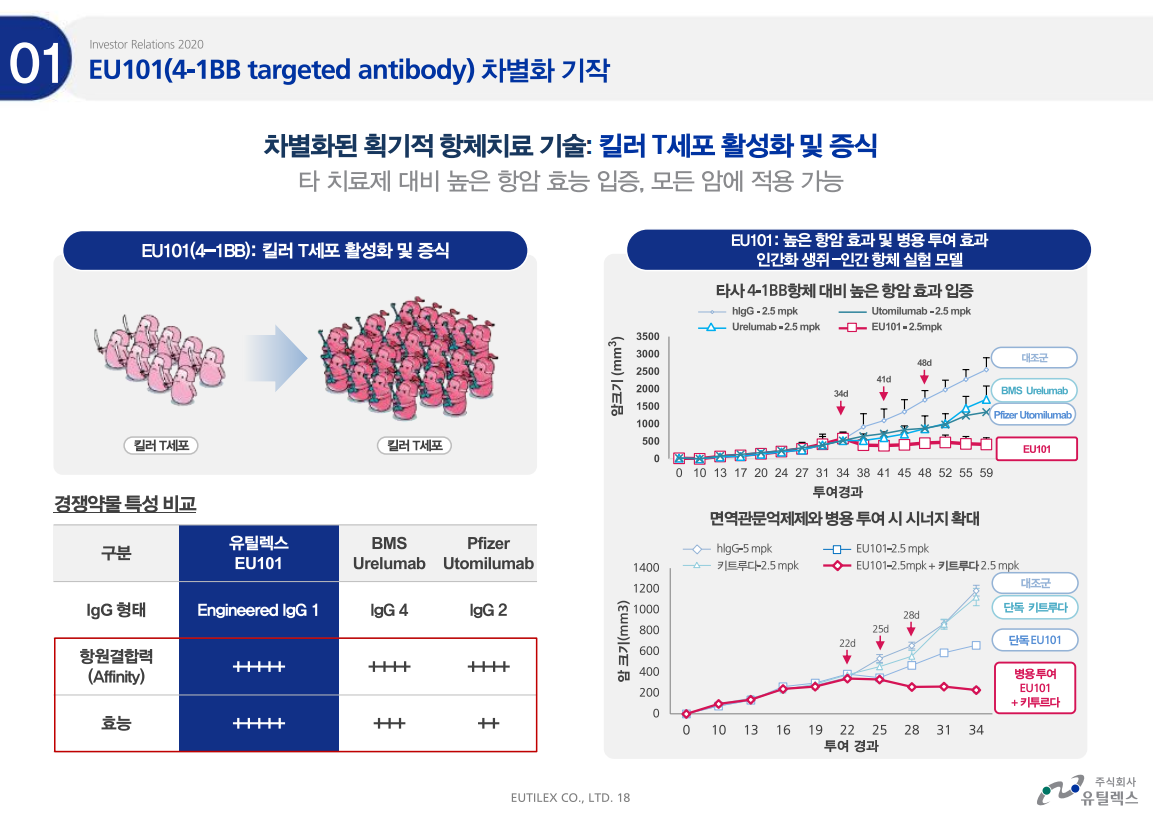
유틸렉스의 미국 자회사 유틸로직스가 세포치료제 생산 및 임상 진행을 위해 여러 업체들과 계약을 체결했다.
- 펩타이드 스크리닝: 리서치디엑스(ResearchDX)
- 펩타이드 생산: 라이프틴(Lifetein)
- 항암제 전문 임상시험수탁기관: 온코베이(OncoBay)
유틸로직스는 2017년에 설립한 유틸렉스의 미국법인이다. 미국에서 임상을 진행하기 위해 설립햇다.
이번 계약은 EBViNT와 TAST의 미국 임상을 진행하기 위한 것이다. 유틸렉스는 현재 항체치료제인 EU101이 미국에서 임상 진행중이다. 계획대로라면 EBViNT는 올해 내로 미국 FDA에 임상 신청을 한다.
최근에 다른 면역항암제 기업인 엔케이맥스가 미국에서 진행 중인 불응성 고형암 임상 1상에서 CR이 나왔다. 유틸렉스도 기술력이 있는만큼 좋은 결과가 있길 기대한다.
유틸렉스는 미국 자회사 유틸로직스(Eutilogics, Inc.)를 통해 세포치료제 생산 및 임상 진행에 필요한 미국 현지 업체들과 계약을 체결했다고 6일 밝혔다.
계약 체결 업체는 펩타이드 스크리닝을 진행하는 리서치디엑스(ResearchDX), 펩타이드를 생산하는 라이프틴(Lifetein) 및 항암제 전문 임상시험수탁기관(CRO) 온코베이(OncoBay) 등 3곳이다.
여기에 임상시험 자문을 맡을 전문가들도 합류했다. 특히 미국 나스닥 상장사 아미리스(Amyris) 및 케이스웨스턴리저브 대학교(Case Western Reserve University) 이사인 제퍼리 듀익(Geoffrey Duyk) 박사가 과학자문위원으로 합류했다.
최수영 대표는 "미국 법인 운영을 본격화하기 위한 그 동안의 노력에 대한 실질적인 진행 성과들이 나오고 있다"며 "이번 항암제 임상 전문 업체 계약 및 과학자문위원 영입을 시작으로 성공적인 치료제 개발에 매진할 것"이라고 했다.
https://www.news1.kr/articles/?4425365
유틸렉스, 미국서 항암 세포치료제 임상시험 본격화
사실 앞에 겸손한 민영 종합 뉴스통신사 뉴스1
www.news1.kr
'주식 > 기업' 카테고리의 다른 글
| 폴리실리콘의 가격상승과 태양광 산업의 중심에 있는 #OCI (0) | 2021.09.11 |
|---|---|
| 엘앤케이바이오, 앤서니 신 박사 인터뷰 요약 (3) | 2021.09.07 |
| #마이크로디지탈, 국내유일 일회용 세포배양시스템 제조업체 (1) | 2021.09.06 |
| #인텍플러스, Powertech Technology와 반도체 검사장비 공급계약 해지 (0) | 2021.09.04 |
| #테고사이언스, 20210825 IR자료 리뷰 (0) | 2021.09.04 |