바이오USA는 ASCO와 같은 임상에 대한 발표를 하는 학회가 아니다. JP모건 헬스케어처럼 바이오업체들간의 정보교류의 장이며, 기술이전에 대한 얘기가 오가는 이벤트다. 6월 13일부터 16일까지 미국 샌디에이고에서 열린다.
알테오젠이 바이오USA에 참석하여 ALT-B4 라이센싱아웃 계약 대면 미팅을 한다.
주주 여러분께,
지난 4월 15일 자로 한경 BIO Insight 에 보도된 '애널리스트가 만난 CEO' 전면 내용을 금일 부터 홈페이지에 공지할 수 있어 한경 BIO Insight 로 부터 pdf 파일을 수령하여 첨부해 드립니다.
다음 주 미국 샌디에이고에서 개최될 '바이오USA 2022' 에 당사도 참석할 예정이며 현재 라이센스아웃 협의 중인 잠재 파트너 사들과 본격적인 대면 미팅이 계획되어 있습니다.
주주 여러분의 변함없는 관심과 성원 부탁 드립니다. 감사합니다.
그리고 경 BIO Insight 에 보도된 '애널리스트가 만난 CEO' 에는 주주들이 평소에 궁금헤하던 사항이 잘 나와있으니 정독하길 추천한다.
알테오젠이 ALT-B4비독점 계약을 하는 이유는 후발주자라서 더 싸게 많이 팔자는 전략 때문이다.

공장증설은 부지는 있으나 eGMP로 지으려면 돈이 많이 들어가니, 직접할지 아니면 다른 업체와 제휴를 맺을지 아직도 고민중이다.

케미컬의약품도 SC제형으로 변형하는 것도 고려하고 있다. 그렇게되면 SC제형 대상 의약품이 늘어난다. Q가 늘어가는 형태다.

히알루로니다아제 판매는 매출에 크게 기여할만큼 돈이 되는 것은 아니고 관리 차원이다.

ALT-P7 임상1상 이후 이렇다할 이벤트가 없는 것은 엔허투가 너무 강하기 때문이다. 엔허투가 1,2차 치료제로 가면 다음 스텝을 고려한다는 전략이다.

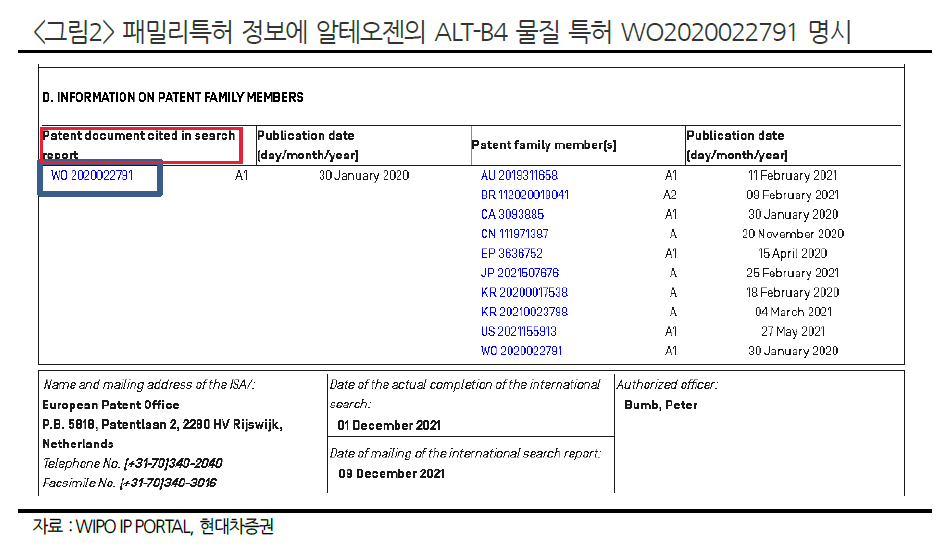
머크가 임상3상에 들어가면 알테오젠의 밸류는 달라질 것이다. 내가 가장 기다리는 이벤트가 추가 LO가 아니라 머크 임상3상 돌입이다. 머크 임상3상만큼 ALT-B4의 경쟁력을 확인시켜줄만한 이벤트는 없다. 머크 임상3상만 들어가면, 자연스럽게 추가 LO는 따라온다.

'주식 > 알테오젠' 카테고리의 다른 글
| 알테오젠, 아일리아 바이오시밀러 제법특허 중국 추가 및 12개국 글로벌 임상3상 첫 환자 투여 개시 (0) | 2022.06.22 |
|---|---|
| 알테오젠, ALT-B4 L/O 한발짝 전진! (0) | 2022.06.17 |
| 알테오젠, ALT-L9 성공의 새로운 복병은 로슈의 바비스모! (0) | 2022.04.27 |
| 알테오젠, 머크로 임상3상 시료 공급 완료 (0) | 2022.04.26 |
| 알테오젠, 머크 특허 명세서를 읽어보면 알테오젠이 보인다! (2) | 2022.04.25 |