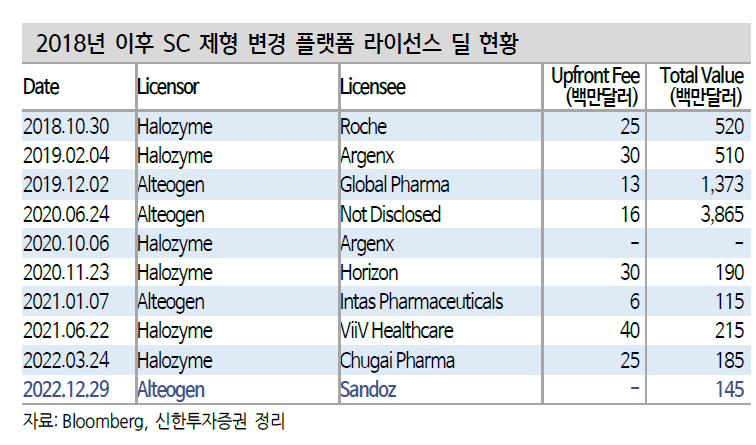
알테오젠이 2022년 12월 30일 ALT-B4를 글로벌 제약사 노바티스의 자회사 산도스와 1839억원 규모의 L/O를 체결했다.
계약형태는 3번째 계약인 인타스와 유사하다. 계약금과 임상개발단계, 판매 허가와 실적 등에 따라 수령하는 마일스톤을 받고, 제품 판매 후 매출 발생 시 최대 두 자릿수 퍼센트의 로열티를 수령한다.
이번 계약은 산도스가 개발하는 1개 품목이지만 향후 산도스는 2개 품목에 대한 추가 계약을 할 수 있는 옵션 조항도 보함되었다. 1개 품목은 계약상 비공개지만 연매출 1조원 이상의 블록버스터 의약품이라고 박순재 대표가 밝혔다.
또한, ALT-B4의 생산과 공급은 모두 알테오젠이 한다.
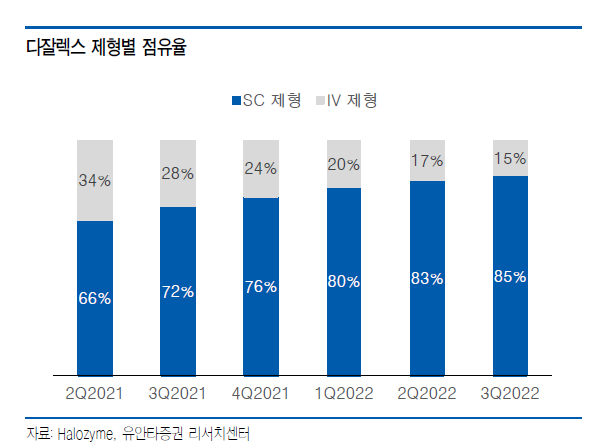
알테오젠은 2019년 사노피, 2020년 머크, 2021년 인타스, 2022년 산도즈(노바티스)까지 매년 1개씩 ALT-B4 기술이전 계약을 체결해오고 있다. 그것이 가능한 이유는 알테오젠은 세계 유일의 바이오시밀러SC제형 플랫폼 회사이기 때문이다.
이번 계약으로 인해 알테오젠은 시장의 신뢰성을 어느정도 회복했다.
이제 추가 무상증자와 자사주 매입도 기대해보자.
알테오젠, Sandoz AG(산도스)와 독점적 글로벌 라이선스 계약 체결
주주 여러분께,
당사의 ALT-B4 관련 소식 공유해 드립니다.
당사는 2022년 12월 29일 자로 Sandoz AG(산도스)에 자사가 개발 중인 1개 품목에 대해 독점적 기술 수출 계약을 체결했습니다. 2018년 ALT-B4에 대한 개발을 시작한 이래 4번째로 체결된 라이선스 기술 수출 계약입니다. 계약 상대방 회사인 산도스 사는 스위스 바젤에 본사를 두고 있으며 노바티스(Novartis) 그룹의 제네릭/바이오시밀러 사업 부문을 담당하고 있습니다. 세계 최초의 바이오시밀러 인 '옴니트로프'를 위시로 다양한 제품을 개발하면서 제네릭과 바이오시밀러 분야에서 글로벌 시장을 선도하고 있습니다.
세계적인 바이오시밀러 회사 산도스 사와 이번 SC제형 제품의 개발을 위한 독점적 계약 체결을 통해 당사의 ALT-B4의 확장성을 더욱 넓힐 수 있는 매우 중요한 계기가 되었으며 이번 계약은 특히 글로벌 유일의 "SC제형 바이오시밀러 플랫폼 제공자"로서 알테오젠의 위상과 시장의 신뢰를 제고함으로써 글로벌 바이오 기업으로 도약하는 기반이 될 것으로 생각하고 있습니다.
현재 알테오젠은 Hybrozyme™ 플랫폼의 강화를 위해 다양한 지식재산권을 확보하고 있습니다. 그 일환으로 SC제형 항체의약품에 대한 특허를 전세계에 출원함으로써 일본에 이어 최근 한국에도 특허 등록을 허가 받았습니다. 뿐만 아니라 알테오젠은 글로벌 유일의 SC제형 바이오시밀러 플랫폼 제공자로서 피하주사(SC)제형 바이오시밀러를 위한 ALT-B4의 제형특허의 PCT 출원을 마친 상태입니다.
2022년 세모를 맞이하여 4번째 기술 수출 계약 체결 소식을 주주 여러분들과 함께 공유할 수 있어서 더욱 기쁘게 생각합니다. 이 보다 좋은 유종의 미는 없을 것 같습니다. 2023년에도 더욱 분발하는 알테오젠이 되겠습니다.
주주 여러분의 변함없는 관심과 성원 부탁 드립니다. 감사합니다.