국내 기업으로는 최초로 뉴욕 상장과 그 파급력이 국내 이커머스 시장의 재평가를 가져올 것이라는 기대감으로 쿠팡의 상장을 지켜보는 사람들이 많다.
쿠팡의 상장 기대감은 아직 끝난 것이 아니다. 이제 시작에 불과하다.
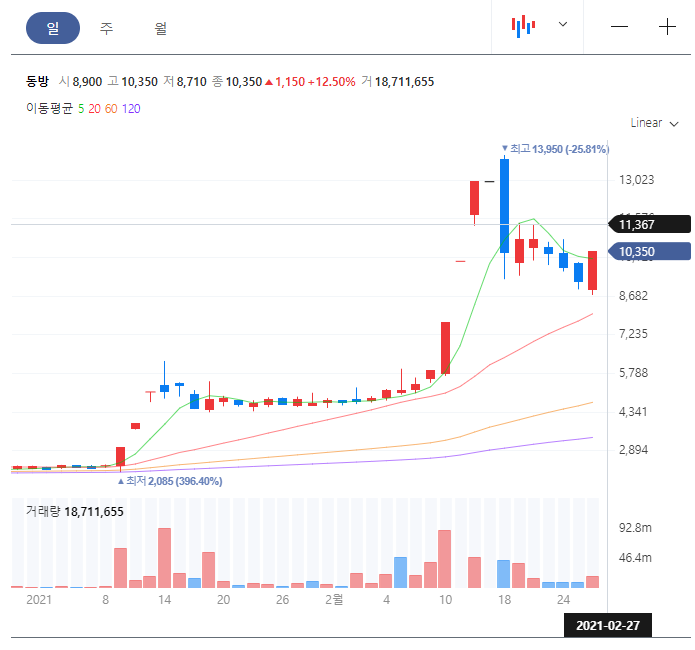
쿠팡 상장 관련주인 동방의 차트를 보면 최고점을 찍고 하락세를 이어오다가 오늘 5일선을 넘었다. 그리고 11300원대의 저항선을 뚫는다면 다시 한번 랠리를 시작할 것으로 보인다.
그 시점은 쿠팡 상장과 관련된 뉴스가 나오는 시점이 될 것이다. 지난 설날에 쿠팡이 증권신고서를 제출했으니깐 3월에는 그와 관련된 후속 기사들이 나올 것으로 추정된다.
2021/02/13 - [주식/산업] - #쿠팡 관련주, 쿠팡 뉴욕증시 상장 신고서 제출
아직 끝나지 않은 쿠팡 상장 관련주를 주목하자. 장이 안좋을 때는 이런 테마주가 좋다.
코로나 팬데믹으로 촉발된 '언택트’ 트렌드와 함께 이커머스 시장은 어느 산업보다도 급격하게 요동치며 기업의 비즈니스 패러다임 역시 변화를 맞이하고 있다.
글로벌 이커머스 시장에서는 아마존과 알리바바가 치열한 격전을 벌이는 중이다. 미국·캐나다·유럽·일본·인도는 아마존이, 중국·동남아·러시아는 알리바바가 시장을 장악하고 있다.
한국은 아마존과 알리바바가 장악하지 못한 국가 중 최대 수준의 이커머스 시장으로 꼽힌다.
중소벤처기업진흥공단이 시장 조사업체 '이마케터' 자료를 활용해 발간한 '글로벌 이커머스 HOT 리포트'에 따르면, 지난해 한국의 이커머스 시장 규모는 1041억 달러로 글로벌 5위를 기록했다.
아마존과 알리바바는 전세계에서 가장 빠른 변화를 보이는 한국의 이커머스 시장에 눈독을 들이며 지난해 말부터 국내 공략에 시동을 걸었다. 아마존은 국내 최대 이동통신사 대기업과 손을 잡고 한국시장 진입을 선언하는가 하면, 알리바바그룹은 물류 계열사인 차이니아오(菜鳥) 스마트 로지스틱스 네트워크(Cainiao Smart Logistics Network)의 한국 시장 진출을 알렸다.
이 가운데 국내 이커머스의 중심에 있는 쿠팡의 뉴욕 상장 소식이 국내 이커머스 업계를 뜨겁게 달구고 있다.
‘로켓배송’을 필두로 소비자들의 일상 소비에 깊숙이 파고든 쿠팡의 혁신적인 서비스는 전국민의 생활 편리화에 기여하며 백화점이나 마트로 향하던 발길을 돌려 놓은지 오래다.
이제 ‘한국의 아마존이 되겠다’는 꿈에 한 발짝 더 다가서며 거대 자본시장에서 글로벌 기업에 걸맞은 가치 평가를 앞두고 기대감을 모은다.
쿠팡의 예상 가치는 블룸버그 추산인 33조2000억원부터 월스트리트저널 추산인 55조4000억원까지 50조원 수준을 넘나든다. 쿠팡은 IPO를 통해 수혈한 자금으로 추가 투자에 나설 것으로 보인다.
미국 증권거래위원회(SEC)에 제출한 상장 신고서에 '2025년까지 5만명 분의 일자리를 창출할 것'이라며 '서울 외 지역 발전을 위해 사회기반시설과 일자리 창출에 수 조원을 투자할 것'이라는 구상도 밝혔다.
쿠팡의 뉴욕 상장은 미래 성장을 위한 공격적 투자는 물론, 국내 이커머스 서비스를 강화해 해외 진출의 발판으로 삼기 위한 포문으로도 읽힌다. 글로벌 수준의 자금 조달을 통해 알리바바, 아마존 같은 글로벌 유통 거인들과 정면 승부를 벌일 것이라는 관측도 나온다.
2014년 국내에서 첫 번째로 유니콘에 입성한 쿠팡이 세계 시장에서 성장 가능성과 가치를 인정받는다면, 그 의미와 파급력은 상당하다.
해외 진출을 꿈꾸는 국내 벤처기업과 스타트업의 성장과 발전에 강력한 청신호이자 새로운 리더십으로 작용함은 물론, 해외 투자자들이 한국 기업을 바라보는 시각 전환에도 기여할 수 있다.
투자은행(IB) 업계에서는 쿠팡을 시작으로 국내 이커머스 업계의 글로벌 평가 가치 또한 긍정적 영향을 받을 것이라고 입을 모은다.
한 업계 관계자는 “쿠팡의 상장은 지난해 거래 규모가 급성장하면서 변곡점을 맞은 국내 이커머스 시장 성장을 가속하는 촉매로 작용해 업계 저변을 넓히고, 쿠팡의 가치 상승만큼 이커머스 업계에 대한 관심과 평가도 더욱 높아질 것”이라고 전망했다.
www.segye.com/newsView/20210225516957?OutUrl=naver
‘상장’ 날개 단 쿠팡, 알리바바·아마존과 어깨 견줄까? [일상톡톡 플러스]
코로나 팬데믹으로 촉발된 '언택트’ 트렌드와 함께 이커머스 시장은 어느 산업보다도 급격하게 요동치며 기업의 비즈니스 패러다임 역시 변화를 맞이하고 있다. 글로벌 이커머스 시장에서...
segye.com
'주식 > 산업' 카테고리의 다른 글
| #크래프톤 상장 관련주, 크래프톤 장외 주가 급등 (0) | 2021.03.21 |
|---|---|
| AACR 2021 참가 국내바이오기업 리스트 (0) | 2021.03.17 |
| #쿠팡 관련주, 쿠팡 뉴욕증시 상장 신고서 제출 (0) | 2021.02.13 |
| #비트코인, 테슬라가 쏘아올린 불씨로 관심을 가져야할 시기 (0) | 2021.02.12 |
| 쿠팡 나스닥 상장 위해 국내외 투자자모집 IR진행중 #쿠팡 관련주 (0) | 2021.02.10 |



