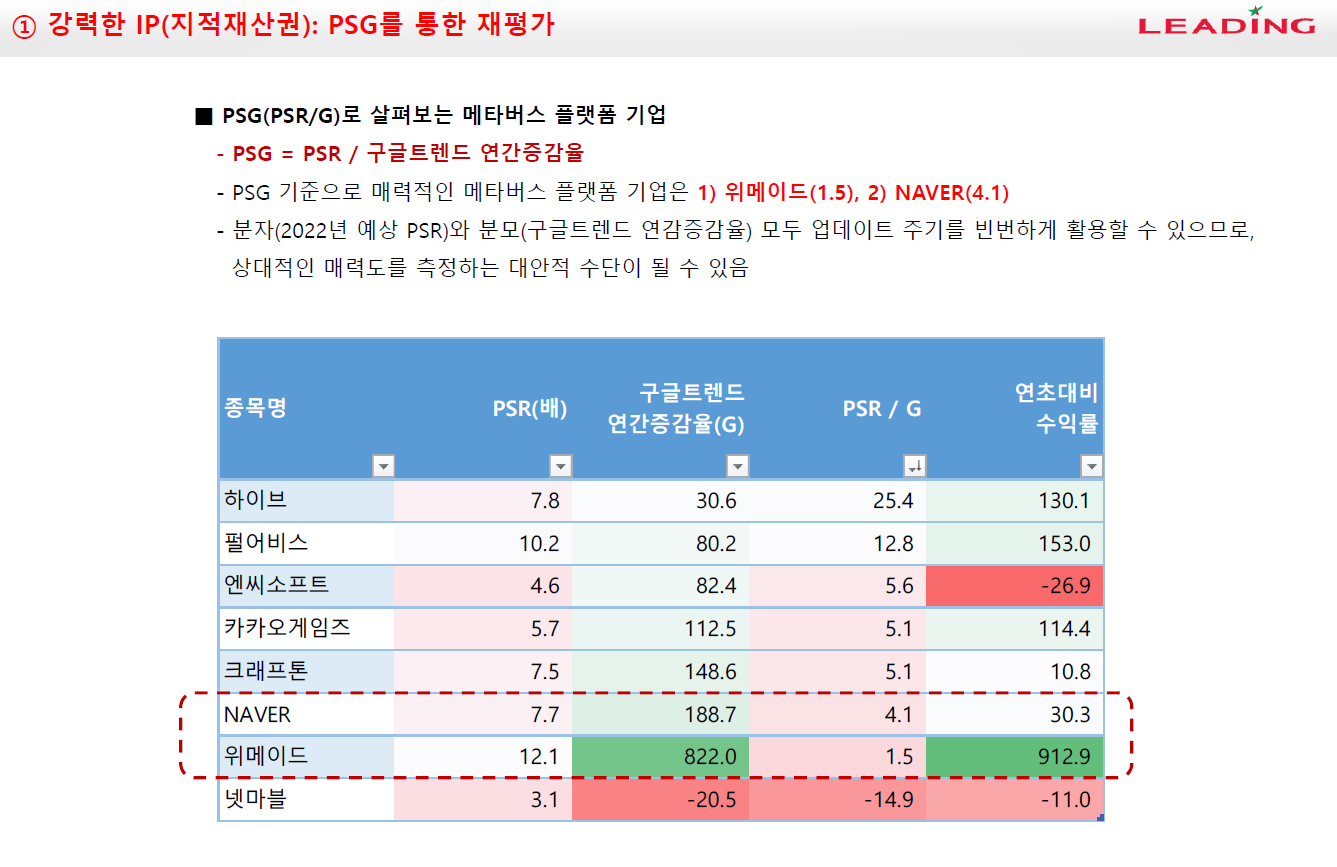
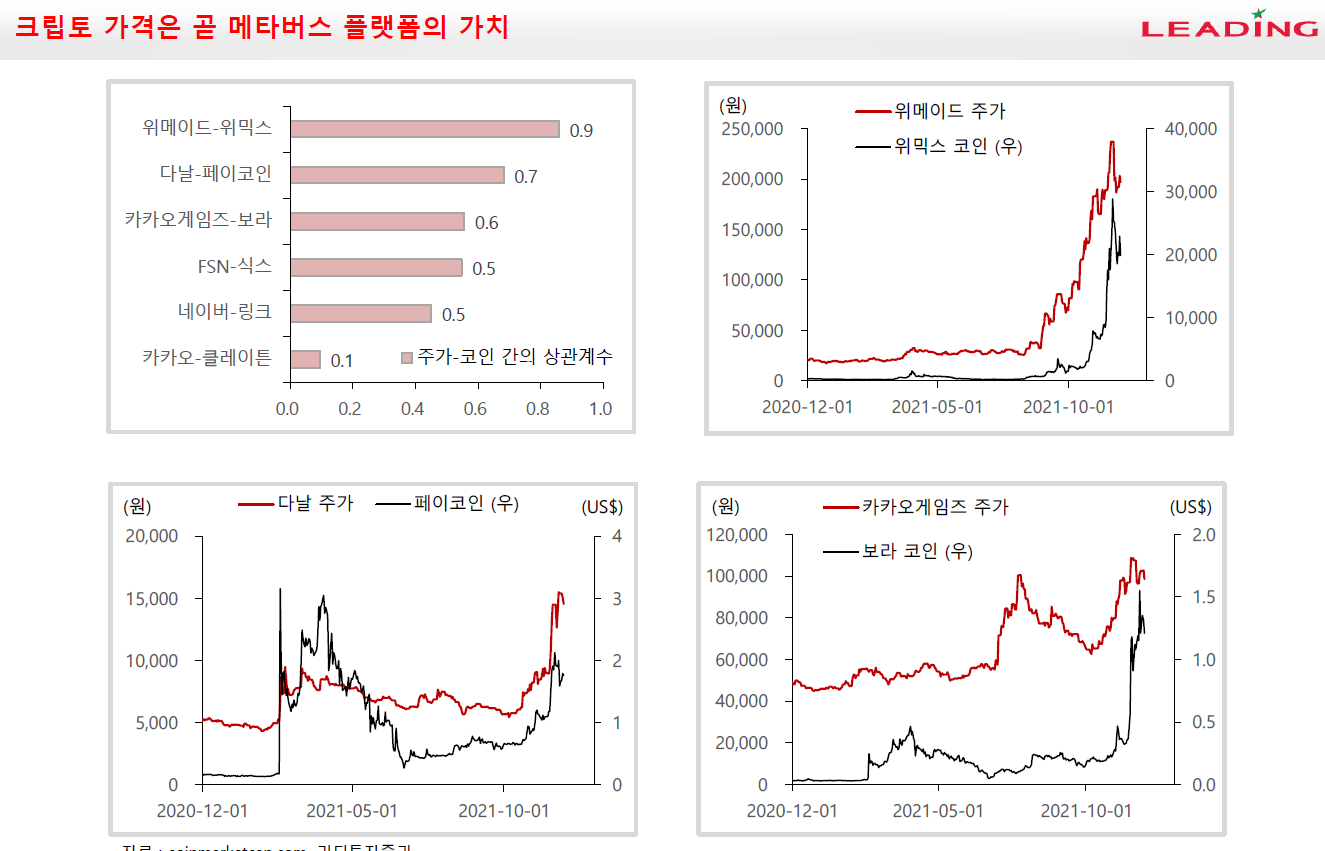
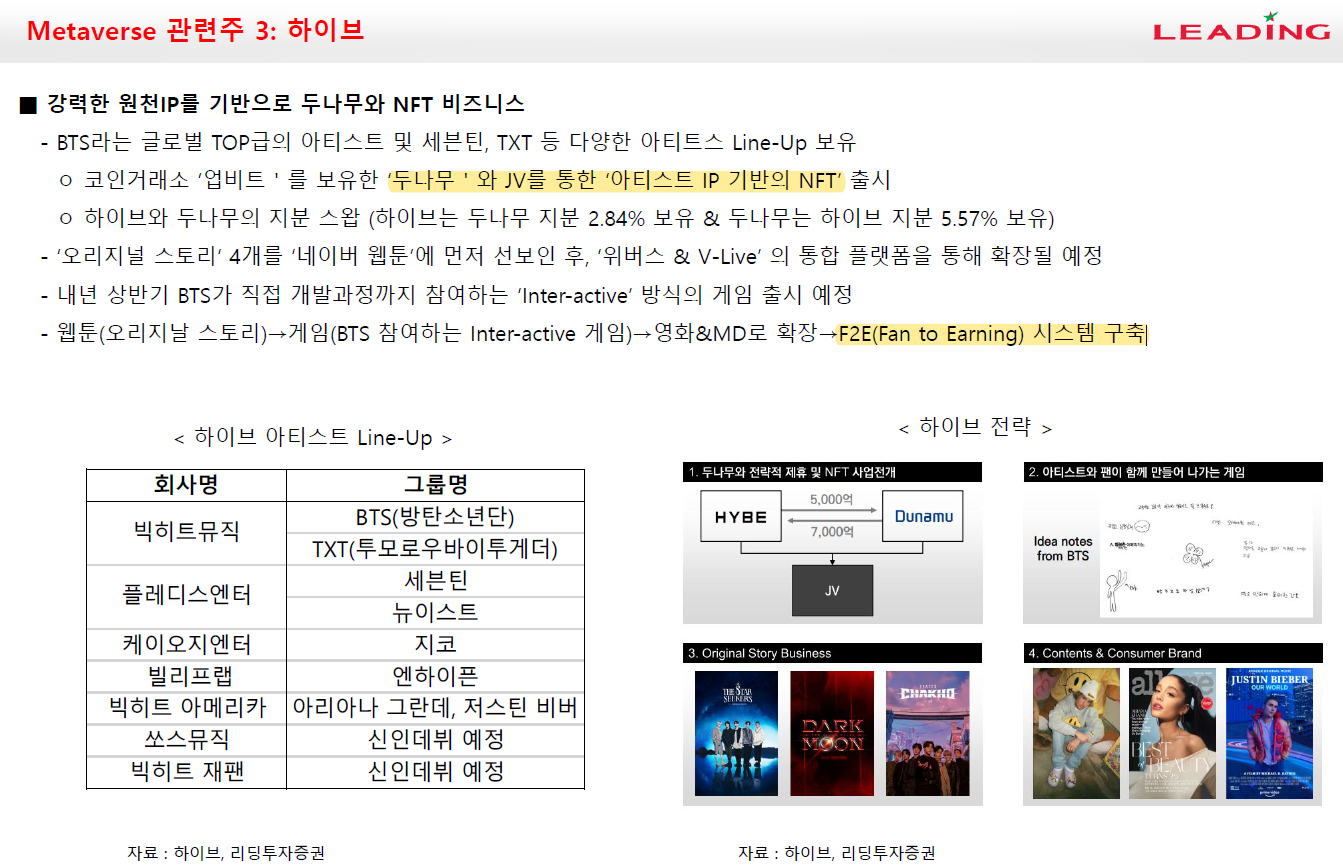
이오플로우가 이오패치 판매 공급계약을 체결했다.
체결 상대방은 인도네시아 기업인 PT. Prasasti Nusantara Sukses이며 계약금액은 계약금액은 453억 2662만원이다.
이오플로우의 매출이 워낙 없기 때문에 작년 매출대비 성장률은 209,316.90%다. 공급계약기간은 5년으로 2026년 12월 5일까지다. PT. PNS는 이오플로의 이오패치를 5년간 인도네시아에 독점판매한다. 계약규모가 최소판매량 기준이기 때문에 시장의 성공여부에 따라 액수는 커질 수도 있다.
PT. PNS는 일회용 의료기기 생산 및 판매 전문업체로 인도네시아 현지 유통 네트워크를 통해 이오패치를 공급한다. 인도네시아는 유럽CE인증으로 판매허가가 가능하기 때문에 제품 등록만 되면 바로 판매할 수 있다.
인도네시아는 성인 당뇨인구가 거의 2천만명에 달하는 중국, 인도, 파키스탄, 미국에 이어 세계에서 5번째로 당뇨인구가 많은 국가다. 그런데 아직 인슐렛이 진출하지 않은 국가다.
이오플로우는 인슐렛이 진출하지 않은 아세안 지역을 공략하여 선점효과를 이용해 파이를 키운다는 전략을 가지고 있다.
이 전략은 분명히 나쁘지 않다. 하지만 인슐렛이 10년동안 독점해온 웨어러블 인슐린펌프 시장인데 아세안지역에는 왜 진출을 하지 않았을까도 생각해봐야 한다.
문제는 가격이라고 생각한다. 인슐린펌프는 일반 주사기에 비해 가격이 매우 비싸다. 편의성과 가격을 맞바꾸는 것이다. 그렇기 때문에 보험적용이 되지 않으면 국내는 물론 유럽, 미국에서도 판매가 힘들다. 그런데 인도네시아의 당뇨인구가 많다고는 하나 그 인구 중에서 일부분만이 부유층일텐데 과연 얼마나 이 시장에서 먹힐지가 의문이다. 인도네시아에서의 판매량을 지켜보면 이오플로우의 전략에 대한 가능성도 어느정도 추정해볼 수 있을 것으로 보인다.
이오플로우는 현재 유럽, 한국, 인도네시아, 중국에서 판매 또는 판매할 예정이다.
Upcoming Events
- 이오플로우
- 2021년 하반기: 인도네시아회사와 CMO협상중, 다수업체와 이오패치 수주협상중(인도네시아 PT. PNS 체결)
- 2021년 12월: 유상증자, 무상증자
- 2022년 1월: 유무상증자 주식 상장,
- 2022년 1분기: 이오패치X FDA신청, 이오패치X 국내 임상 시작, 이오패치 국내건강보험적용
- 2022년 상반기: 이오패치 유럽 17개국 출시, 이오파니 FDA 신청
- 2022년: 중동 진출, 이오패치 제2형당뇨 임상종료
- 2022년 하반기: 이오패치&이오펌프 생산량 300만대
- 2023년: 인도네시아 S사와 CMO를 통해 300만대 생산, 이오패치X출시
- 2025년: 이오파니 출시
- 파미오(웨어러블 신약 개발 자회사)
- 비알콜성간염 신약 공동개발 발표 예정(빠르면 12월 중)
- 네프리아(웨어러블 인공신장 미국 자회사)
- 2022년: 몸에 부착할 수 있는 신장투석기 시제품 확보를 목표로 개발 중
- 시노플로우(시노케어와 JV)
- 2021년 하반기: 중국회사와 JV설립(10월 26일 이후 영업일 60일이내)
- 2025년내: 중국시장 제품 출시(이오펌프는 이오플로우가 공급
1. 공시제목
- EOPatch 등의 독점판매계약 체결
2. 계약의 주요내용
(1) 공급금액 : 5년간 USD 38,260,000.00
(원화:45,326,622,000원- 적용환율 2021년 12월 07일 환율 1,184.70원/$1.00)
(2) (1번)의 공급금액은 5년간 최소구매수량에 당사의 예상판매단가을 곱한 금액임
- 1차년도 : 108,000개
- 2차년도 : 240,000개
- 3차년도 : 360,000개
- 4차년도 : 480,000개
- 5차년도 : 600,000개 (총 1,788,000개)
(3) 공급예상시기 : 2021년 12월 06일 ~ 2026년 12월 05일
(4) 최근사업연도 매출액 대비 : 209,316.90%
(2020년 연결기준 매출액 21,654,545원을 근거로 산정된 비율입니다)
(5) 2021년 12월 06일
(6) 공급품목
- EOPatch Insulin Management System
- EOPatch
- ADM
- Narsha
- EOBridge
3. 계약 상대방에 관한 사항
(1) 계약상대방 : PT. Prasasti Nusantara Sukses(인도네시아)
(2) 최근매출액 : 약 170억원
(3) 주요사업 : 일회용 메디칼 제품을 생산 및 판매
(4) 판매지역 : 인도네시아
(5) 회사와의 관계 : 없음
4. 기타 참고할 사항
(1) 상기 공급금액은 최소판매 예상수량으로 계산된 금액입니다
PO접수 등에 의해 확정될 경우, 단일판매. 공급계약 공시의무에 따라
공시 진행예정입니다
(2) 최근사업연도 매출액은 2020년 연결기준 매출액(21,654,545원)입니다
5. 정보제공자
(1) 정보제공자 : 이오플로우 주식회사
(2) 정보제공 당사자 : 국내/외 투자자 등 이해관계자ㅣ
(3) 정보제공일자 : 2021년 12월 07일
6. 공시관련 연락처
(1) 공시책임자: 대표이사 김재진
(2) 공시담당자: 경영기획실장 연민욱
(3) 관련부서 : 경영지원실
(4) 전화번호 : 031-724-0241 |