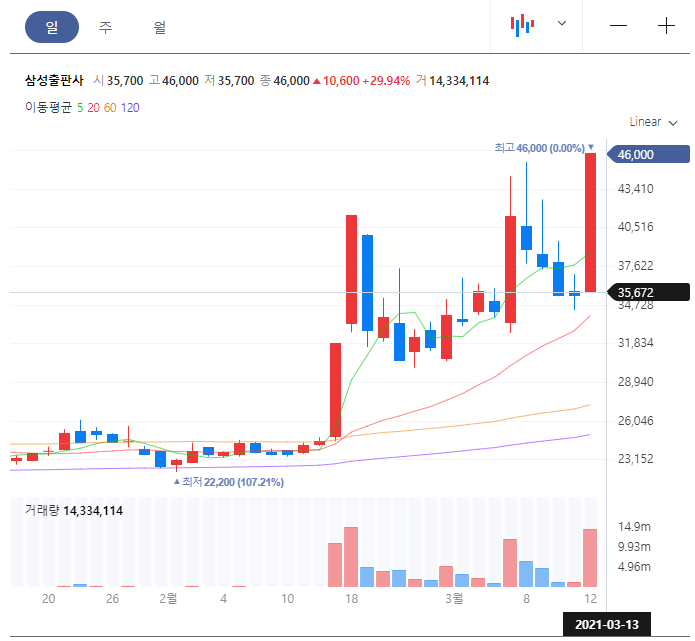
더이상은 악재가 없다고 판단했던 엘앤케이바이오에서 악재가 발생했다.
엘앤케이바이오의 미국판매법인 Aegis Spine가 미국 일리노이주에서 Life Spine사와 소송 중이었는데 3월 15일 일부제품 판매중지 가처분 결정을 받았다.
판결내용은 AccelFix-XT를 판매하지 못하도록 예비금지 명령을 내렸고, 판사는 Aegis Spine 임원의 증언을 인용하여 Life Spine에게 나중에 금지 명령이 잘못된 것으로 판명될 경우 손실을 충당하기 위해 6 백만 달러의 보증금을 지불하도록 명령했다.
즉, Life Spine이 한화로 약 70억 정도를 공탁하면 AccelFix-XT 판매금지 가처분을 집행시켜준다는 것이다.
소송의 전말은 Life Spine이 Aegis Spine를 2018년에 계약한 유통계약을 위반하고 Life Spine의 브랜드인 ProLift의 영업비밀을 부당하게 사용했기에 소송을 제기한 것이다.
소송의 판결문을 보면 Life Spine이 이에 대해 많은 증거자료를 가지고 있어보인다.
판사는 두 회사의 계약서를 통해 Aegis Spine이 유통 및 청구 계약의 기밀조항을 위반했을 가능성이 높아보인다고 판단하였다.
계약 당시 Life Spine은 엘앤케이바이오가 자체 척추 케이지라인을 개발 중이며 Life Spine의 ProLift 라인의 핵심인 척추 디스크 높이를 복원하기 위한 확장형 케이지를 설계하는데 난항을 겪고 있따는 사실을 알지 못했다.
유툥계약 체결 후 Aegis Spine의 대표는 엘앤케이바이오에게 엘앤케이바이오의 변리사에게 Life Spine의 ProLift 케이지 중 하나를 보냈다. 근데 그 경위가 엘앤케이바이오의 변리사가 Aegis Spine에게 실제품을 보는 것이 엘앤케이바이오의 AccelFix-XT 개발에 도움이 될 것이라고 말했기 때문이다. 엘앤케이바이오의 변리사는 박스를 열지않았다고 증언했고, Life Spine은 박스가 회수되었을 때 비어있었기 때문에 반품처리를 할 수 없었으며 위조방지 스티커가 이중으로 되어있었다고 증언했다. 따라서 판사는 이와 연관된 증거는 부족하다고 판시했다.
그로부터 1년 후 Aegis Spine은 AccelFix-XT 척추 케이지를 출시했으며, 전시회에서 개발 과정을 알게 된 후 Life Spine이 소송을 제기했다.
그 결과가 판매금지 가처분 결정으로 나온 것이다.
엘앤케이바이오의 입장에서는 지금 이 판결로 인해 진행중인 계약건이나 향후 판매과정에서 문제가 생기게 되었다.
악재가 발생해버렸으니 피할 수는 없다. 그나마 다행인 것은 AccelFix-XT에만 적용된다는 것이다. 나머지 제품은 상관없다.
이제 이 것을 어떻게 극복해나가는 것이 중요하다.
엘엔케이바이오의 조치는 공시내용을 보면 가처분집행시 적극적으로 본안소송에서 대응하여 기각판결을 받거나 영업적 합의점을 모색한다고 한다.
기각판결은 뚜렷한 다른 증거가 없는한 힘들어보인다. 그게 있었다면 가처분결정도 받지 않았을 것이다.
그렇다면 두번째 방안으로 가야한다. 그것은 돈을 주고 소송을 끝내는 것이다.
어떤 금액으로 어떻게 협상할지가 관건이다. 그리고 그것이 빠른 시일내로 이루어져서 현재 진행중인 계약에 차질이 발생하지 않도록 하여야한다.
엘앤케이바이오에게 큰 문제가 생겼으니 회사의 향후 대응을 지켜보며 어떻게할지 생각해보자.
기타 경영사항(자율공시)
| 1. 제목 | 종속회사(미국판매법인 Aegis Spine, Inc.) 일부제품 판매중지 가처분 결정 | |
| 2. 주요내용 | 과거 원고와 종속회사 사이에 체결하였던 대리점 계약에 따른 종속회사의 미국내 Accelfix-XT cage 판매잠정 중지결정 | |
| 3. 결정(확인)일자 | 2021-03-16 | |
| 4. 기타 투자판단에 참고할 사항 | ||
| [향후대책] 1. 가처분결정의 판단이유 및 적용범위를 면밀히 분석하고, 원고의 공탁($6M)으로 가처분 결정 집행시 본안 소송에서 적극적으로 대응 하여 기각판결을 구함. 2. 영업적 합의점 도출을 중도 모색함. [기타 참고사항] 1. 종속회사를 상대로한 소송으로 당사에 대한 구속력은 없음. 2. 당사의 특허 등 고유기술 부분에 대한 분쟁은 없음. 3. 당사의 다른제품(XL,XTP)판매에 영향 없음. 4. XT의 경우 미국외 다른지역 판매에 영향 없음. 5. 새로운 제품의 추가 출시 예정 |
||
| ※ 관련공시 | - | |
'주식 > 엘앤케이바이오' 카테고리의 다른 글
| 엘앤케이바이오, 주주총회 간단 정리 (0) | 2021.03.25 |
|---|---|
| 엘앤케이바이오, AccelFix-XT Cage 판매금지가처분 이슈 해결책은? (0) | 2021.03.19 |
| 엘앤케이바이오, 라이센싱아웃 계약 발표가 늦어지는 이유는? (0) | 2021.03.01 |
| 엘앤케이바이오, 기존2업체 외 다수의 업체와 판권 협상중 (0) | 2021.02.18 |
| 엘앤케이바이오, 2021년 영업이익률 60% 이상 가능 (0) | 2021.02.17 |