미래에셋증권에서 나온 머크 리포트를 읽어보자.
키트루다SC의 수요는 증가할 것이며, 현재 진행중인 SC제형 임상은 허가신청 목표로 순항 중이라고 한다.
풀어서 해석해보면, 알테오젠의 ALT-B4를 가지고 키트루다를 SC제형으로 변형하여 임상 1상을 진행 중인데, 순조롭게 잘 진행되고 있다는 의미다. SC제형은 3상에서도 실패할 가능성이 낮다.

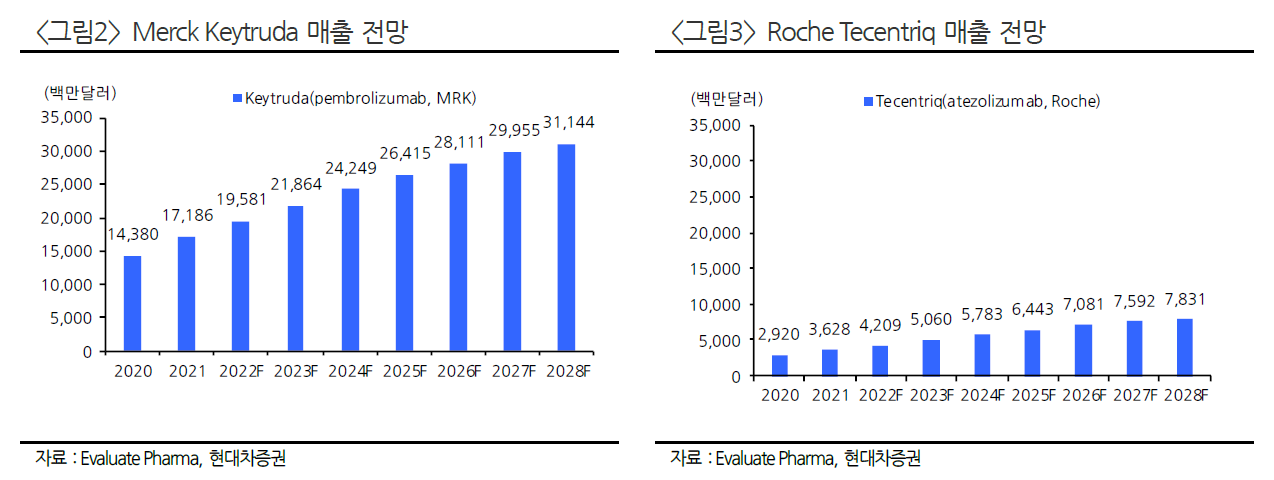
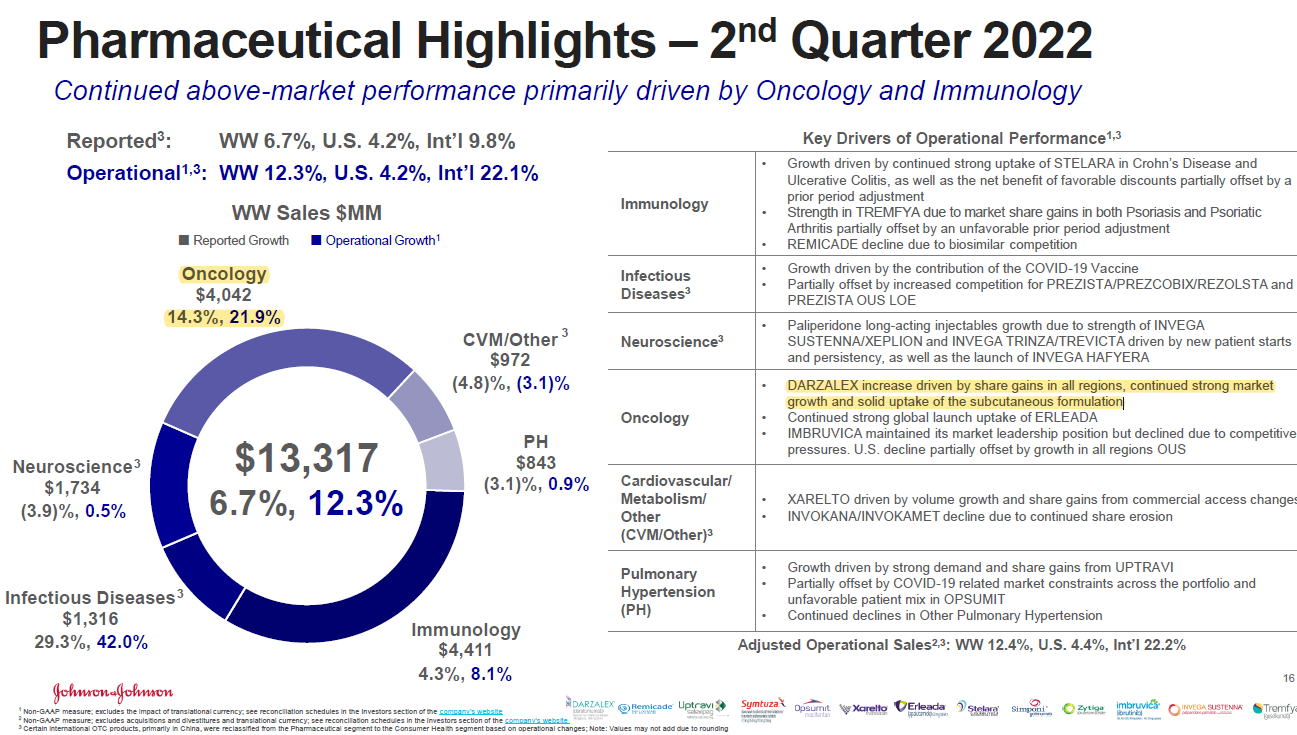
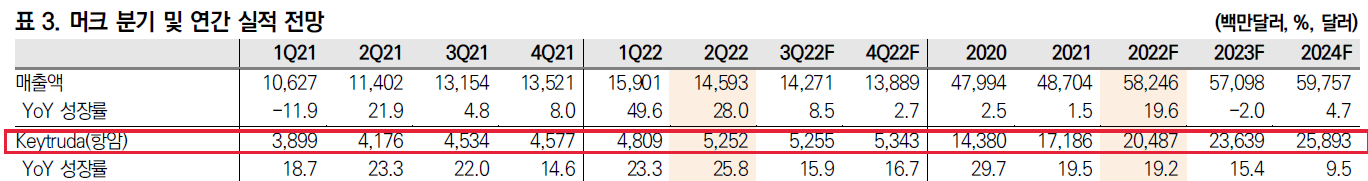
키트루다는 컨센서스보다 실적이 잘 나왔다. 두 말이 필요없는 세계1위 항암의약품이다.

분기 매출추이를 보면, 가장 이상적이고 아름다운 그래프다. QoQ로 계속 매출이 증가한다.
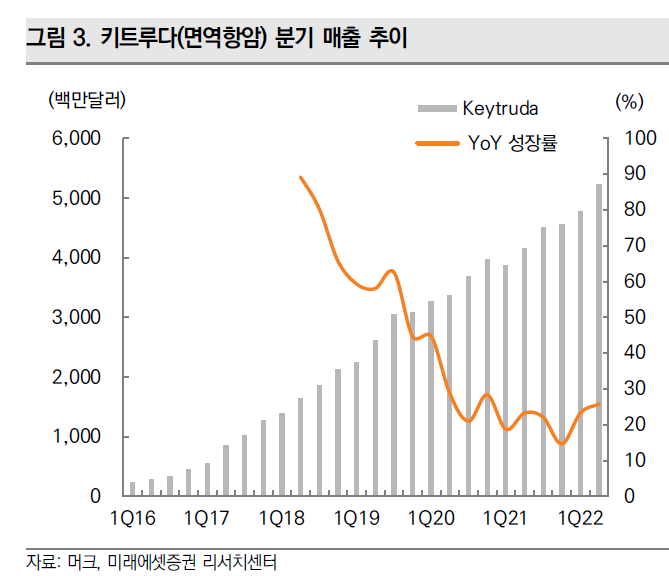
키트루다의 매출성장은 연평균 10% 이상 꾸준히 성장할 것으로 예상하고 있다.
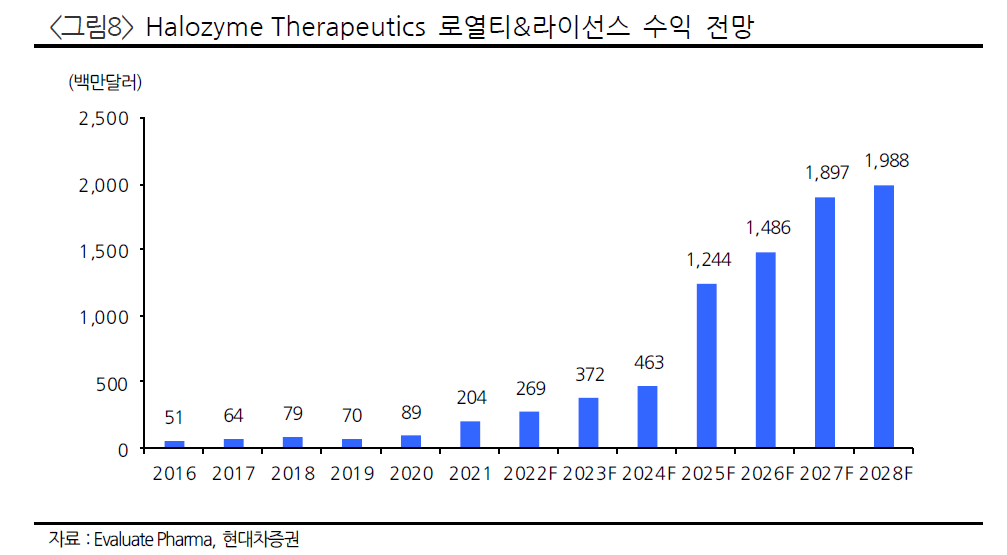
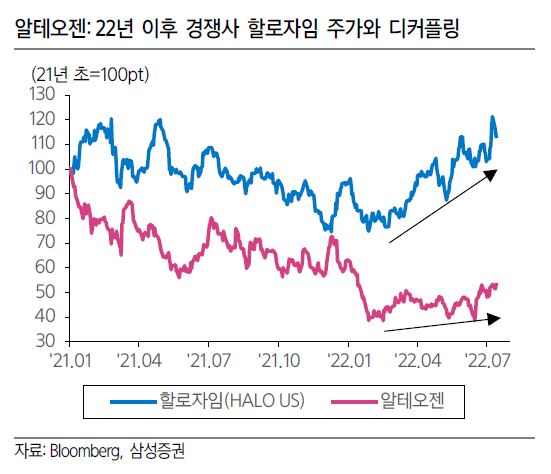
키트루다와 함꼐하고 있는 알테오젠에 대한 기대가 큰 것은 당연한 것이 아닐까?
'주식 > 알테오젠' 카테고리의 다른 글
| 알테오젠, 키트루다 임상3상은 내년 초! (0) | 2022.08.10 |
|---|---|
| 알테오젠, MTA체결 6건 중에서 한 건만이라도 L/O해보자 (0) | 2022.08.09 |
| 알테오젠, 올해 및 내년도 기술이전 기대 (0) | 2022.08.05 |
| 알테오젠, 승자는 정해져 있다 Feat. 현대차증권 (0) | 2022.08.04 |
| 알테오젠, 다잘렉스 성장률 고공행진->SC제형변경 인기 (0) | 2022.07.21 |