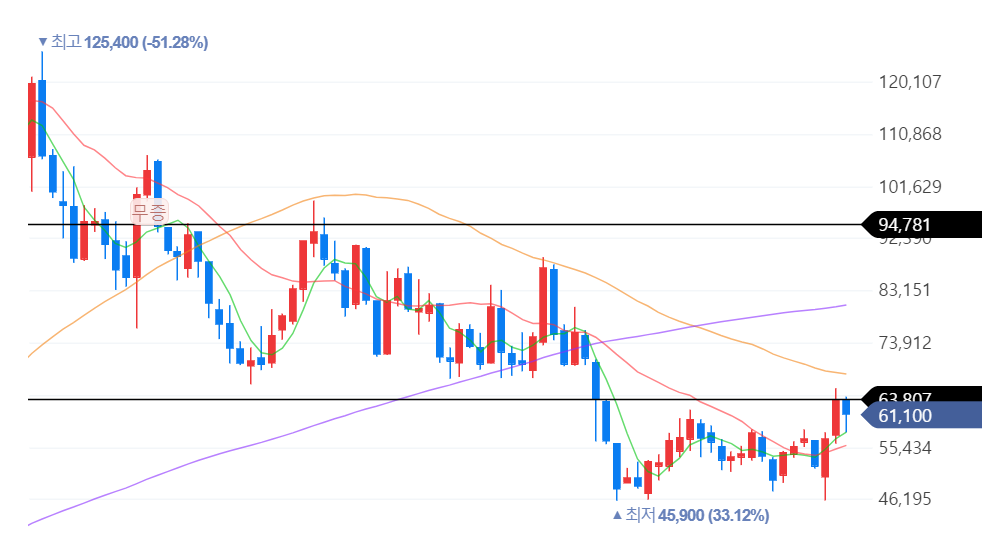
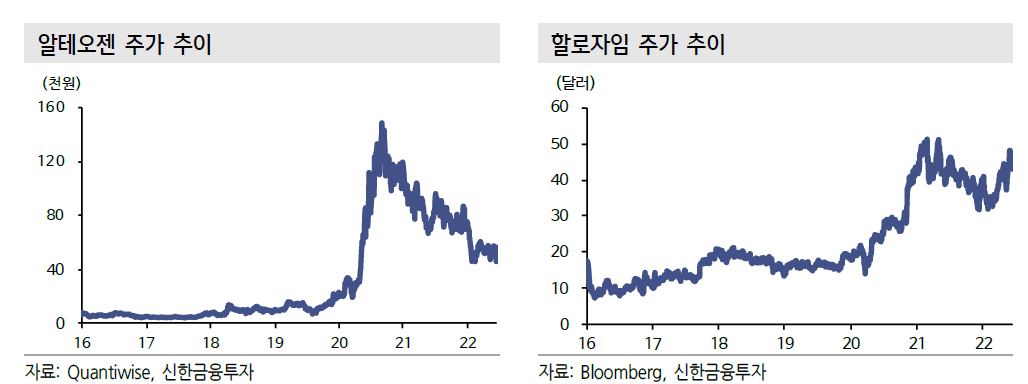
삼프로TV에 출연한 현대차증권의 엄민용 연구원의 인터뷰에서 알테오젠에 대한 내용만 들어보자.
머크의 키트루다만으로 30조원 규모의 매출을 발생시키는데, 키트루다SC가 30%만 차지해도 10조원이며 그에 따라 알테오젠의 로열티 수익은 1조원에 달할 수도 있다고 한다.
시총 55조의 삼성바이오로직스의 작년 매출이 1조원 수준이다.
그리고 알테오젠은 ALT-B4외에도 ALT-L9이 있다. 아주 낙관적으로 본다면 알테오젠은 아직 시작도 안했다고 볼 수 있다.
https://www.youtube.com/watch?v=lOkhqyvmkC4
'주식 > 알테오젠' 카테고리의 다른 글
| 알테오젠, ALT-L9(아일리아 바이오시밀러) PFS 제형 한국 특허 등록 (0) | 2022.07.12 |
|---|---|
| 알테오젠, ALT-L9 미국 제법특허 등록 결정! (0) | 2022.07.05 |
| 알테오젠, ALT-L9 한국 임상3상 승인 (0) | 2022.07.03 |
| 알테오젠, ALT-B4 추가L/O는 기정사실화 분위기 (0) | 2022.07.02 |
| 알테오젠, 키트루다 임상1상 종료 의미는 ALT-B4 검증통과! (0) | 2022.06.30 |