인테글러스가 지난 3월 29일 체결한 Powertech Technology와 반도체 검사장비 공급계약이 해지되었다.
2021.03.29 - [주식/기업] - #인텍플러스, Powertech Technology와 반도체 검사장비 공급계약 체결
해지 사유는 계약상대방의 해지 통보라고 한다. 계약금액이 62억원인데 해지에 따른 보상금액으로 22억원인걸로 봐서는 반도체 시장이 예상보다 좋지 않아 공급계약을 철회한 것이 아닐까 예상한다.
단일판매ㆍ공급계약해지
| 1. 판매ㆍ공급계약 해지내용 | 반도체 검사 장비 | ||
| 2. 해지내역 | 해지금액(원) | 6,238,100,000 | |
| 최근매출액(원) | 40,530,902,130 | ||
| 매출액대비(%) | 15.39 | ||
| 3. 계약상대방 | Powertech Technology Inc. | ||
| -회사와의 관계 | - | ||
| 4. 계약기간 | 시작일 | 2021-03-26 | |
| 종료일 | 2021-08-31 | ||
| 5. 주요 해지사유 | 계약상대방의 계약해지 통보 | ||
| 6. 해지일자 | 2021-08-31 | ||
| 7. 공시유보 관련내용 | 유보사유 | - | |
| 유보기한 | - | ||
| 8. 기타 투자판단에 참고할 사항 | - 상기 2. 해지내역의 해지금액은 USD 5,500,000 이며, 상기 해지금액은 서울외국환중개(주)가 고시하는 2021년 3월 26일의 매매기준율 1,134.2원/USD를 적용하여 환산한 금액입니다. - 상기 2. 해지내역의 최근매출액은 최초공시 당시의 최근사업연도말인 2019년도 12월 31일 연결재무제표 기준입니다. - 상기 5. 주요 해지사유는 계약상대방의 해지 통보이며, 당사의 귀책사유가 아닙니다. 이에 대해 보상 금액 USD 1,950,000을 지불하겠다는 공문을 수령하였습니다. - 상기 보상금액은 영업적 손실에 대한 보상으로 각 장비별 제조 진행률에 따라 책정하였습니다. - 상기 6. 해지일자는 계약상대방으로부터 계약해지 메일을 수령한 일자입니다. |
||
| ※관련공시 | 2021-03-29 단일판매ㆍ공급계약체결 |
||
'주식 > 기업' 카테고리의 다른 글
| #유틸렉스, EBViNT와 TAST 미국 임상 준비중 (0) | 2021.09.07 |
|---|---|
| #마이크로디지탈, 국내유일 일회용 세포배양시스템 제조업체 (1) | 2021.09.06 |
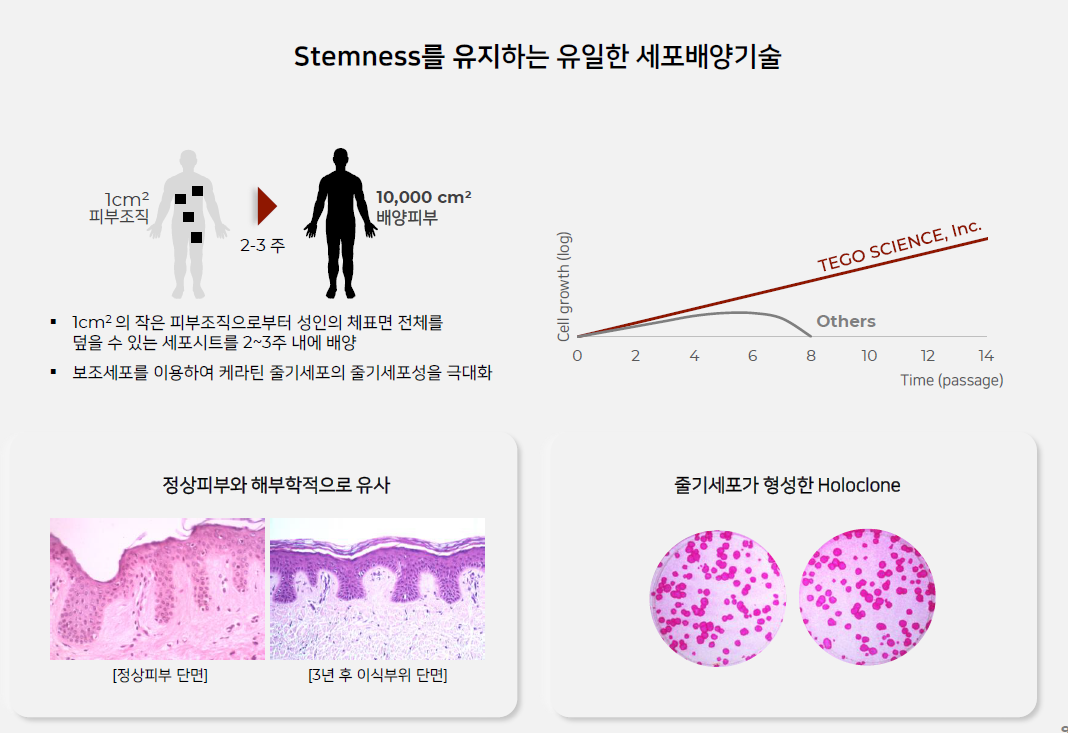
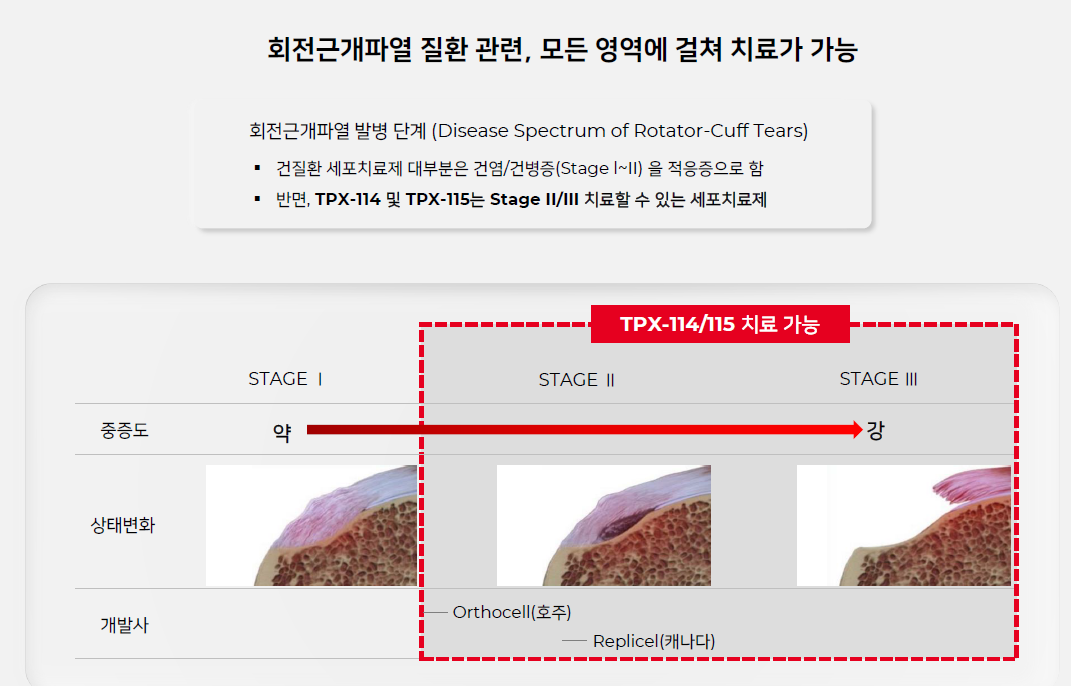
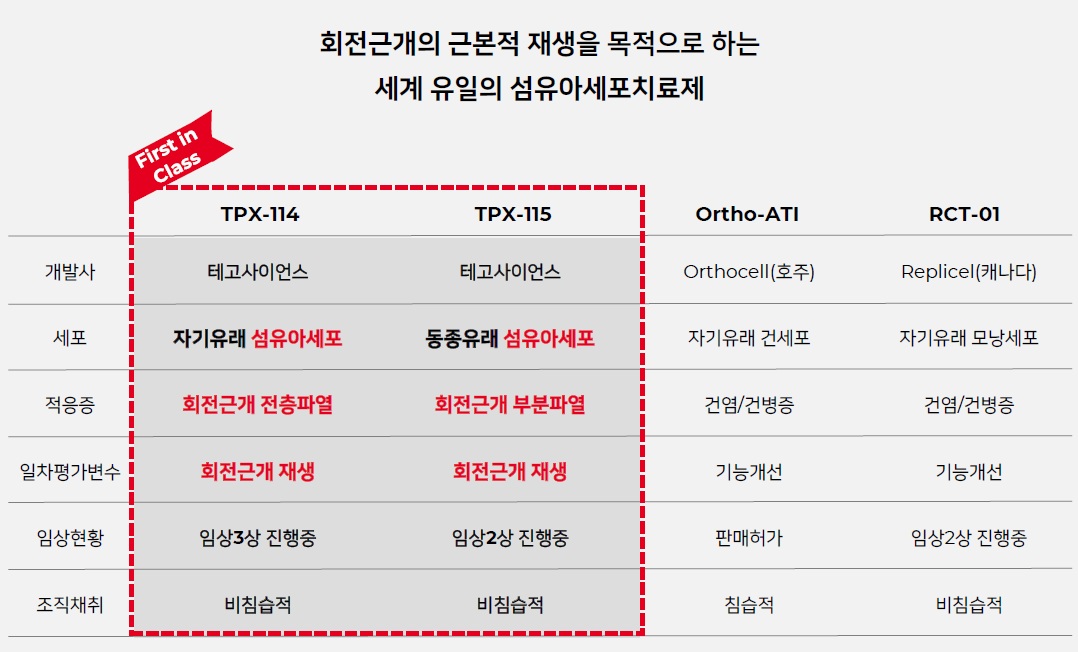
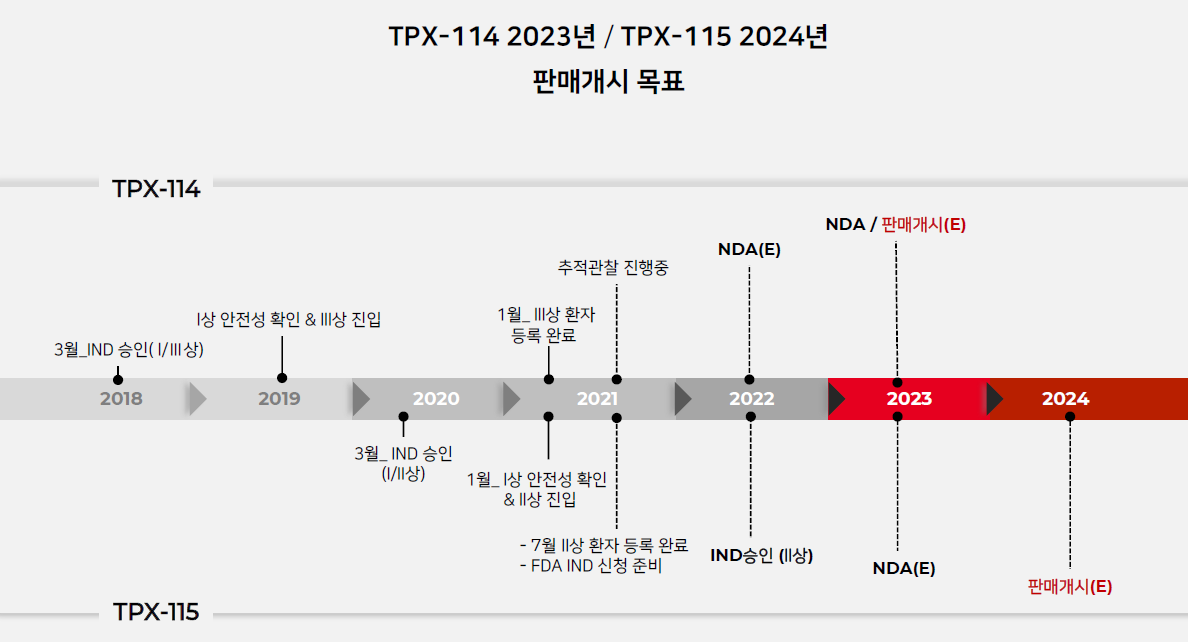
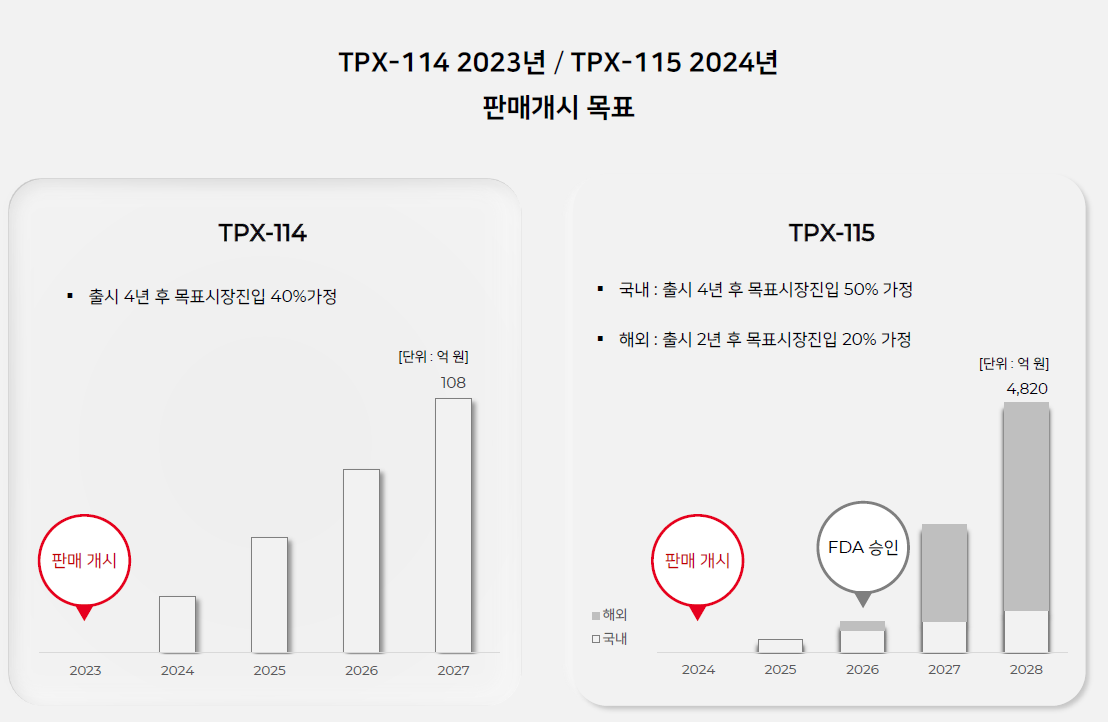
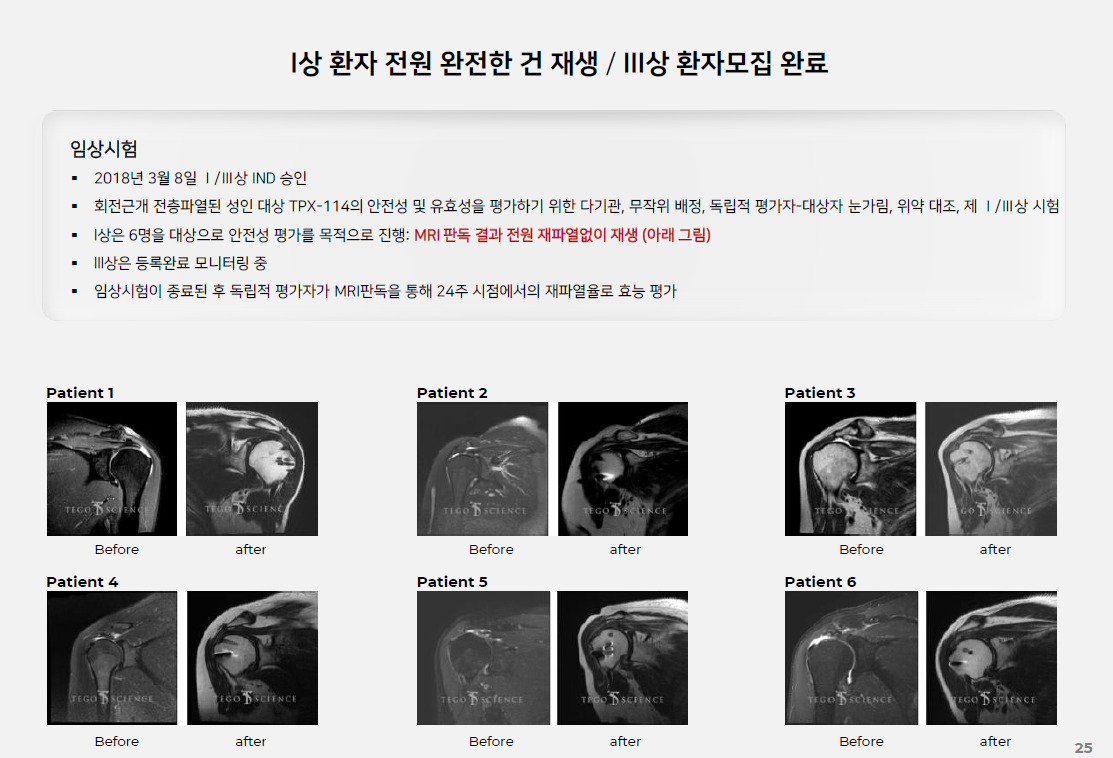
| #테고사이언스, 20210825 IR자료 리뷰 (0) | 2021.09.04 |
| #테고사이언스, 모낭 삼차원 배양피부모델 개발 프로젝트 시작 (0) | 2021.09.03 |
| #박셀바이오, 박스루킨-15 비교동등성 시험 완료 -> 9월 중순 서류 제출 (0) | 2021.09.01 |