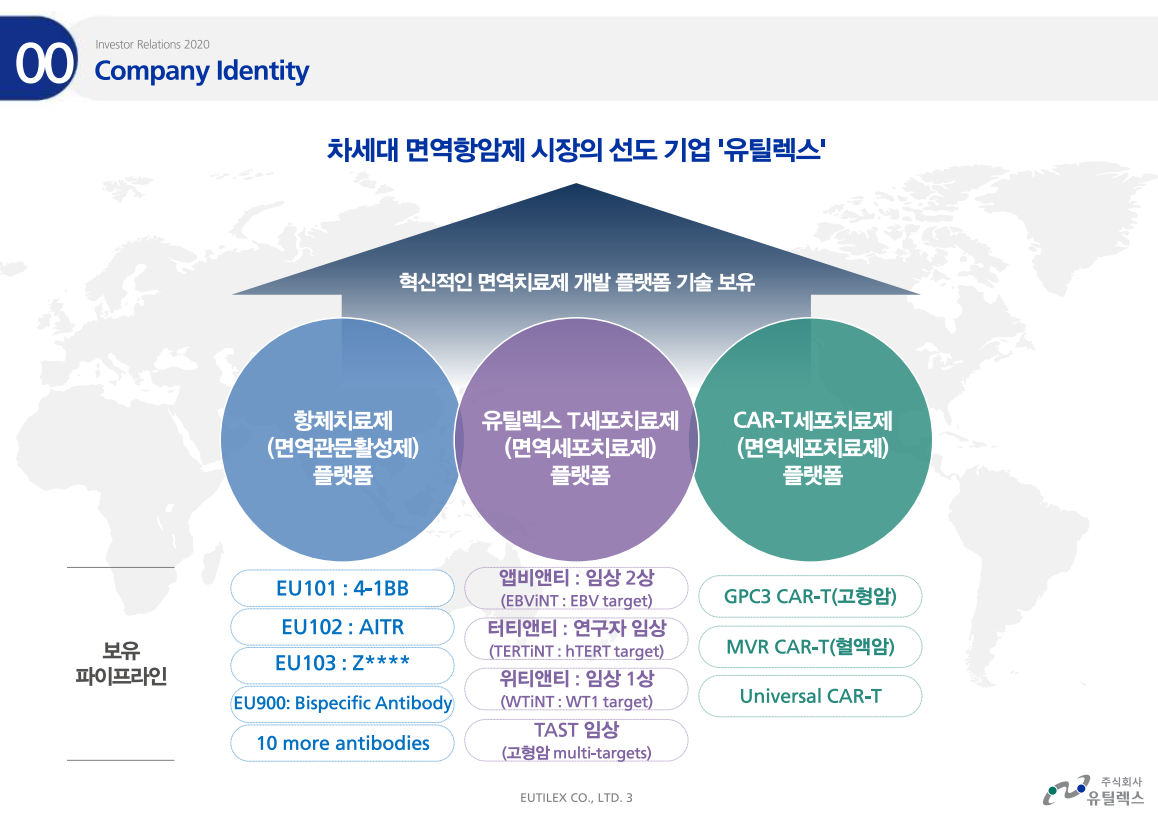
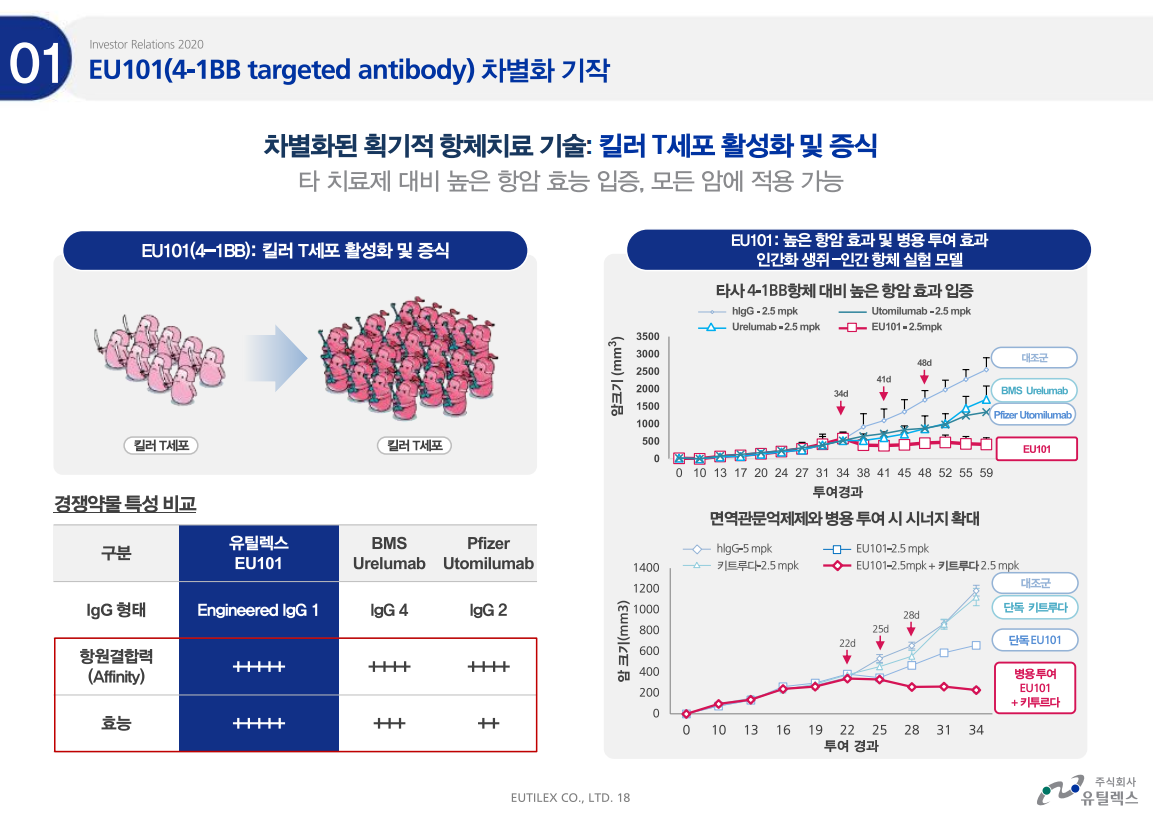
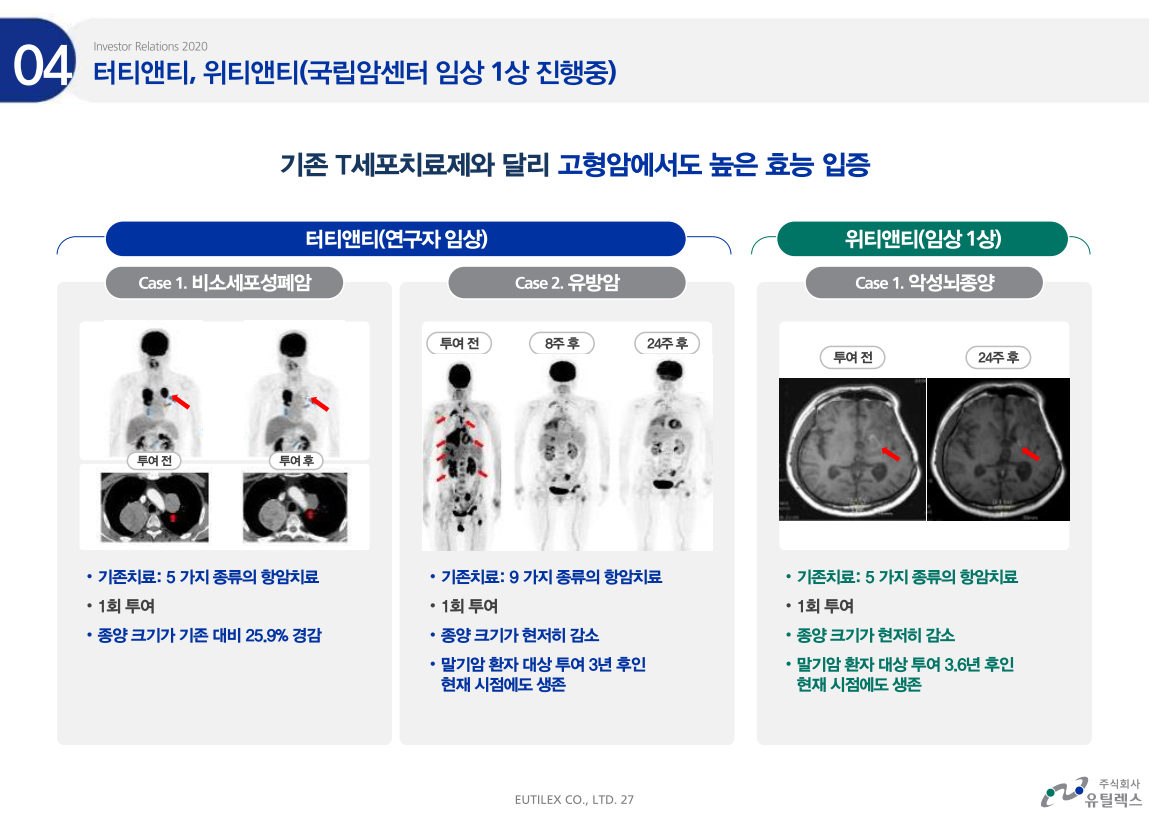
엘앤케이바이오가 미국시장에서 공격적으로 바뀌었다.
기존에는 대리점 판매나 병원에서 직접 판매하는 전략을 취했는데 이제 직접 미국에 XYPAN이라는 브랜드를 런칭하여 판매하려고 한다.
엘앤케이바이오의 익스팬더블 케이지를 XYPAN이라는 브랜드를 붙여서 이지스 스파인이 판매하는 것이다. 그래서 결국 자체 브랜드파워를 강화시켜 시장의 입지를 강화시킨다는 전략이다.
향후에는 이지스 스파인이 척추 임플란트 뿐만이 아니라 관절 임플란트를 비롯하여 척추 및 관절의 외과수술에 사용되는 바이오 제품까지 포함하는 포트폴리오를 구축하는 것이 목표라고 한다.
회사가 제시하는 비전은 정말 아름답다. 현재 시점에서는 그 비전에 도달하기 위해 한계단씩 잘 성장하고 있어보인다.
척추임플란트 전문업체 엘앤케이바이오는 15일 미국 자회사인 이지스 스파인이 지난달 29일 높이확장형 추간체고정보형물(높이확장형 케이지)에 대해 'XYPAN'이라는 브랜드로 미국 식품의약국(FDA) 승인을 받았다고 밝혔다.
주식회사 엘앤케이바이오는 미국의 척추 전문 유통업체인 이지스 스파인(Aegis Spine)의 지분을 약 74.3% 보유한 최대주주이다. 이지스 스파인은 모회사 엘앤케이바이오의 미국 현지 자회사 이면서 동시에 엘앤케이 미국 영업의 총판을 맡고 있다. 지금까지 엘앤케이바이오의 제품을 미국 내에 수입해 병원에 직접 판매하거나 대리점을 통한 간접 판매를 하는 유통업을 영위해 왔다.
이지스 스파인은 올해 척추 및 관절의 모든 제품군에 대해 생산능력 및 유통능력을 모두 갖춘 명실상부한 종합의료기기회사로 탈바꿈 하고 있으며, 이를 기반으로 향후 빠른 시간 내에 미국 나스닥을 도전한다는 목표를 갖고 있다.
이지스 스파인은 올해 기술 라이센싱 받은 제품의 품목허가를 모두 종료하고, 미국 의약품 품질관리 기준 cGMP(Current Good Manufacturing Practice)까지 획득해 제조업까지 사업영역을 확장하는 것을 계획하고 있다.
또한 이번 FDA 허가받은 제품에 대해 제조원으로써 엘앤케이바이오에서 OEM을 통해 생산할 예정이며, 그 밖의 척추 임플란트 제품은 지금과 마찬가지로 엘앤케이바이오로부터 공급받아 유통할 계획이다.
이지스 스파인은 슬관절 전치환술(Total Knee Arthroplasty)에 사용되는 무릎 인공관절(Knee Joint Implant)을 판매하기 위해 한국의 관절 전문업체인 루트락과 공급계약을 체결했으며, 현재 미국에서 판매할 준비를 하고 있다.
이외에도 인공 고관절(Artificial Hip Joint)이나 외상 치료기기(Trauma devices) 등에 대해서도 한국의 우수한 품질을 가진 업체를 발굴하는 작업을 차근차근 진행하고 있다.
엘앤케이바이오 "美자회사 브랜드 'XYPAN' FDA 승인"
AN'이라는 브랜드로 미국 식품의약국(FDA) 승인을 받았다고 밝혔다.주식회사 엘앤
www.inews24.com
'주식 > 엘앤케이바이오' 카테고리의 다른 글
| 엘앤케이바이오, 기존2업체 외 다수의 업체와 판권 협상중 (0) | 2021.02.18 |
|---|---|
| 엘앤케이바이오, 2021년 영업이익률 60% 이상 가능 (0) | 2021.02.17 |
| 엘앤케이바이오, 작년 영업이익 흑자전환->관리종목 지정이슈 제거 (0) | 2021.02.11 |
| 엘앤케이바이오, 익스팬더블 케이지 3종 알아보기 (0) | 2021.02.01 |
| 엘앤케이바이오, 교세라와 Accelfix-XT 공급 체결의 의미 (0) | 2021.01.27 |