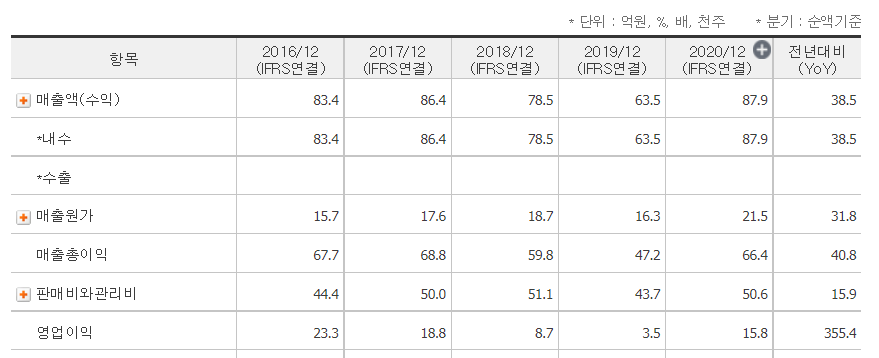
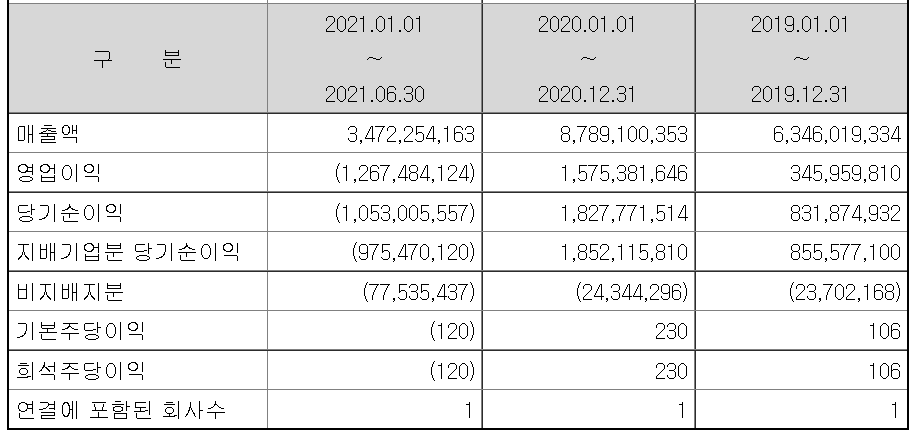
테고사이언스의 2분기 매출이 전년 동기보다는 감소했지만 1분기보다는 36.8% 증가했다. 그리고 영업이익과 당기순이익은 적자로 전환됐다. 하지만 분기보고서가 아니라 반기보고서로 공시가 되었기 때문에 정확한 수치는 잘 모르겠다.
테고사이언스는 매출 증대를 위해 새로운 사업으로 CDMO를 준비중인데 최근 기사들은 계약이 임박했다고 나왔었다.
회사 IR담당자에게 확인한 결과, 계약 임박은 아니며 계약 협의가 진행중이라고 한다. 계약 임박이라는 기사는 회사의 입장이 아니라고 한다.
협의가 진행 중인 것은 사실이므로 시간적 여유를 가지고 지켜보자.
테고사이언스가 2분기 연결기준 매출액 20억 600만 원으로 전년 동기대비 다소 감소했으며, 영업이익과 당기순이익은 적자로 전환됐다고 13일 공시를 통해 발표했다. 1분기와 비교하면 매출액은 36.8% 증가했으며, 적자폭은 대폭 감소하며 회복세를 보였다.
테고사이언스 관계자는 "코로나19 사태의 장기화 여파를 지속적으로 받아 매출액이 전년동기 대비 소폭 감소했다"며 "하지만 적자를 감수하면서도 상반기에 연구개발(R&D)에 공격적으로 투자하고, 자회사 큐티젠랩에 적극적인 마케팅을 진행하는 등 코로나 이후를 준비하고 있다"고 말했다.
이어 "당사의 매출은 연말로 갈수록 증가하는 계절성을 보이며, 현재 진행 중인 여러 사업들의 성과도 점차 가시화되고 있는 만큼 하반기 실적은 회복될 것으로 기대한다"고 설명했다.
테고사이언스는 연초 동종유래 세포치료제 칼로덤의 공동판매 계약을 맺은 SK케미칼을 통해 상반기에 다양한 거래처를 확보했다. 현재 본격적인 영업 및 마케팅을 펼치고 있으며, 이를 통한 매출 상승전환 효과를 기대하고 있다. 다수의 바이오 기업들과의 세포치료제 위탁개발생산(CDMO) 계약 협의도 계속 진행 중이다.
더불어 회사는 국내 임상이 순항 중인 회전근개 부분파열 동종유래 세포치료제 ‘TPX-115’에 대해 미국 식품의약국(FDA)에 사전 임상시험계획(Pre-IND)에 관한 미팅을 가질 예정이다. 미팅 진행 및 결과에 따라 미국 임상 및 해외시장 진출이 가시화될 전망이다.
http://www.medigatenews.com/news/761996946
MEDI:GATE NEWS 테고사이언스, 2분기 매출액 20억 600만원…영업이익·당기순이익 적자전환
테고사이언스가 2분기 연결기준 매출액 20억 600만 원으로 전년 동기대비 다소 감소했으며, 영업이익과 당기순이익은 적자로 전환됐다고 13일 공시를 통해 발표했다. 1분기와 비교하면 매출액은 3
medigatenews.com
'주식 > 기업' 카테고리의 다른 글
| #유틸렉스, EU101 중국임상1상 2단계 투약 완료 (0) | 2021.08.18 |
|---|---|
| #이오플로우, 2022년부터 매출 본격화 기대 Feat. SK증권 (0) | 2021.08.16 |
| #유틸렉스, 앱비앤티셀 국내 추가 임상 신청 (0) | 2021.08.03 |
| #테고사이언스, 동물실험대체방법 국내특허 취득 (0) | 2021.08.02 |
| #이오플로우, 무효소식 연속혈당측정기술 업체 유엔엑스와 지분교환 (0) | 2021.07.31 |