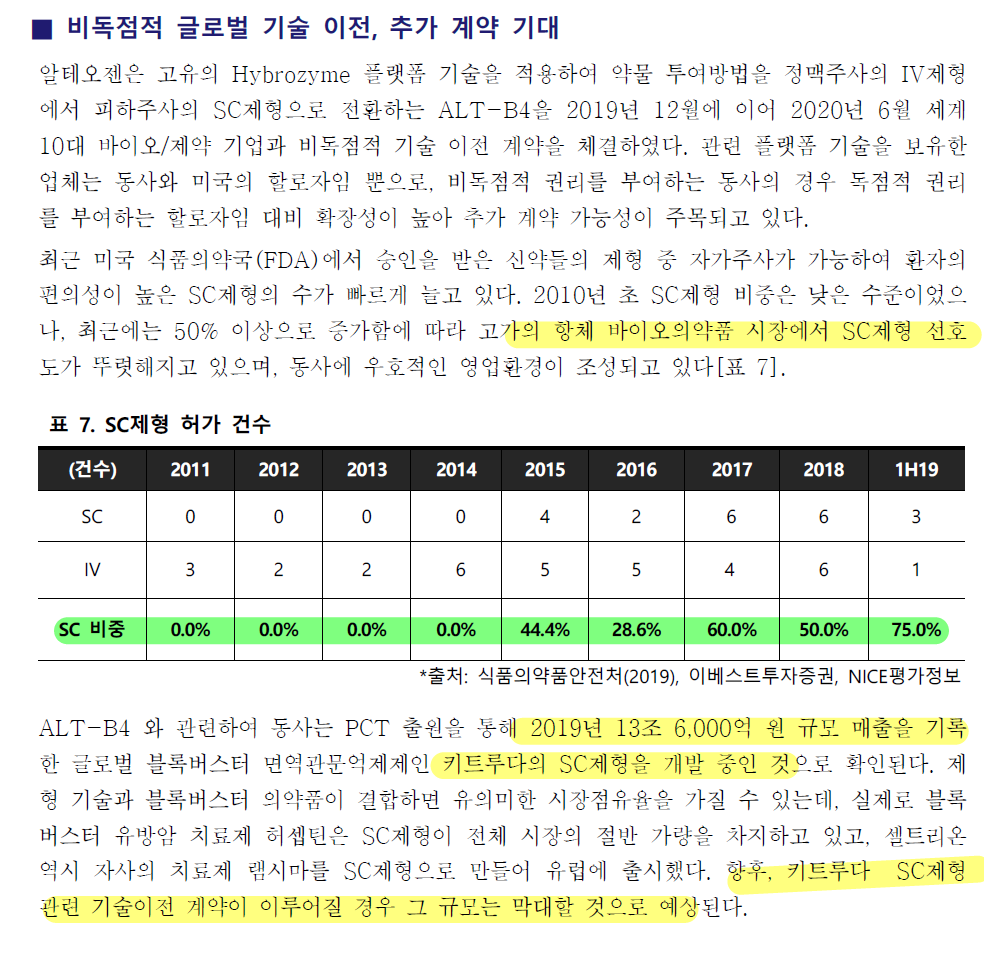
알테오젠은 독일의 머크와 인간 히알루로니다제 ‘ALT-B4’의 생산 공급을 위한 위탁개발생산(CDMO) 계약을 맺었다.
알테오젠과 CDMO 계약을 위해 손잡은 제약사는 독일 머크로, 면역항암제 키트루다를 파는 미국 머크(MSD)과는 별개의 회사다.
전세계에 머크란 회사는 2개가 있다. 독일의 Merck KGaA와 미국의 Merck & Co.이다.
미국 머크는 원래는 독일 머크의 미국지사로 1891년 미국에 설립됐는데, 1917년 제 1차 세계대전에 패하면서 미국정부에 매각되었다. 그 후 1953년 제약 유통업체인 샤프 앤 돔을 합병하면서 이후 MSD(Merck Sharp & Dohme)로 되었다.
미국의 머크는 미국과 캐나다에서만 머크라는 사명으로 활동하며, 이외의 지역에서는 MSD라는 사명을 사용한다. 즉, 다른 지역에서의 머크는 모두 독일의 머크를 의미한다는 것이다. 아마도 상표권 같은 문제로 추정된다.
이번에 알테오젠이 CDMO 계약한 업체는 독일의 머크이다.
이번 계약의 의미는 유럽임상이 임박했다는 것을 의미하며, 이는 마일스톤의 수령도 임박했다는 것을 의미한다.
그리고 계약한 업체가 임상에 돌입하면 그것으로 인해 계약한 업체가 누구인지 추측할 수 있을 것이다. 알테오젠에서는 그것이 공개되는 것만으로도 파급력이 클것이라고 했다.
알테오젠 주주들의 추측과 바램은 첫번째 회사는 사노피이고, 두번째 회사는 키트루다의 MSD이다.
MSD라면 전세계 의약품 시장 1위의 키트루다를 가지고 있기 때문에 그 홍보효과와 파급력은 어마어마할 것이다.
알테오젠이 머크와 BioReliance® End-to-End 솔루션을 통해 인간 히알루로니다제의 (ALT-B4)의 생산 공급을 위한 위탁생산·개발(CDMO) 계약을 체결, 글로벌 생산기지를 확보했다고 25일 밝혔다.
계약에 따라 머크는 알테오젠의 기존 공정을 프랑스 Martillac에 있는 머크의 cGMP 시설로 이전해 피하 주사형 항체 치료제에 사용될 인간 히알루로니다제의 생산을 포함하는 후기 CDMO 서비스를 제공할 예정이다.
머크는 30년 이상의 공정 개발 경험과 25년 이상의 GMP 제조 경험을 바탕으로 260 개 이상의 생물학적 제제를 시장에 출시했고, 2012 년부터 다양한 분자 및 스케일 업 등으로 80 개 이상의 GMP 의약품을 출시했다. 머크의 생물학적 제제 CDMO는 유럽, 미국 및 중국에 3개 시설로 구성돼 있다.
알테오젠은 2019년, 2020년 글로벌 10대 제약사와 인간 히알루로니다제의 기술을 최대 약 1조6000억원, 약 4조7000억원 규모의 계약을 각각 체결했으며, 올해 인도의 인타스 그룹과 두 자리 로얄티를 받을 수 있는 계약을 성공시켰다.
이번에 유럽지역에서 CMO로 머크를 선정하고 인간 히알루로니다제를 생산하는 것은 알테오젠과 제휴를 맺은 글로벌 제약회사들에게 임상시료 및 상업생산 목적의 원료를 공급하는 준비작업의 일환으로 볼 수 있다.
머크의 생명 과학 프로세스 솔루션 책임자 인 Andrew Bulpin은 “자가 치료를 가능하게 하고 삶의 질을 향상시키며 의료 비용을 절감할 수 있는 피하주사에 대한 수요가 증가하고 있다”며 “이 계약은 정맥주사로 대량 투여해야 할 생물학적 의약품을 간단히 피하 투여가 가능하게 하는 혁신적인 차세대 생물학적 의약품를 제공하려는 머크의 전략을 발전시킬수 있을 것”이라고 설명했다.
알테오젠의 관계자는 “이번 계약을 통해 머크의 프로세스 솔루션사업부문에 속하는 프랑스에 위치한 Martillac site가 타 CMO 대비 상대적으로 ALT-B4의 기술이전과 생산에 적합한 규모를 지니고 있고 설비활용 등 전략적인 이해관계가 상호 부합한다고 판단한다”며 “이를 통해 유럽지역 뿐만 아니라 글로벌로 공급할 수 있는 기반이 구축돼 적극적인 글로벌 진출의 발판이 될 것”이라고 기대했다.
또한 “유럽 CMO 설비를 통해 1차 GMP생산이 완료되면, 지난해 계약했던 글로벌 제약사로부터 일부 마일스톤도 수령할 예정”이라며 “향후 글로벌 제약사로 부터 추가적인 기술이전에 대한 문의가 많을 것”이라고 밝혔다.
한편 알테오젠은 인간 히알루로니다제는 두 개의 10대 글로벌 제약사에 기술 이전했고, 히알루로니다제 자체 제품에 대해 올 하반기 제품 출시를 목표로 임상을 진행하고 있다. 이외에도 NexPTM-fusion기술 및 NexMabTM기술을 이용해 다양한 바이오 베터 제품들을 개발 및 임상시험을 진행하고 있으며, 국내 유일한 차별화된 아일리아 바이오시밀러를 개발하고 있다.
www.edaily.co.kr/news/read?newsId=01535046628954128&mediaCodeNo=257&OutLnkChk=Y
알테오젠, 머크와 히알루로니다제 CDMO 계약 체결
알테오젠(196170)이 머크와 BioReliance® End-to-End 솔루션을 통해 인간 히알루로니다제의 (ALT-B4)의 생산 공급을 위한 위탁생산·개발(CDMO) 계약을 체결, 글로벌 생산기지를 확보했다고 25일 밝혔다.계약
www.edaily.co.kr
'주식 > 알테오젠' 카테고리의 다른 글
| 알테오젠, 아일리아 바이오시밀러 ALT-L9 임상1상 종료 (0) | 2021.03.07 |
|---|---|
| 알테오젠, 신규진입자는 타이밍을 노릴 시기 (0) | 2021.03.04 |
| 알테오젠, 2020년 영업이익 532.8% 증가 (0) | 2021.02.25 |
| 알테오젠, ASCO 2021이 기다려지는 이유 (0) | 2021.02.23 |
| 알테오젠, ALT-P1 관련 특허 브라질 등록 (0) | 2021.02.20 |