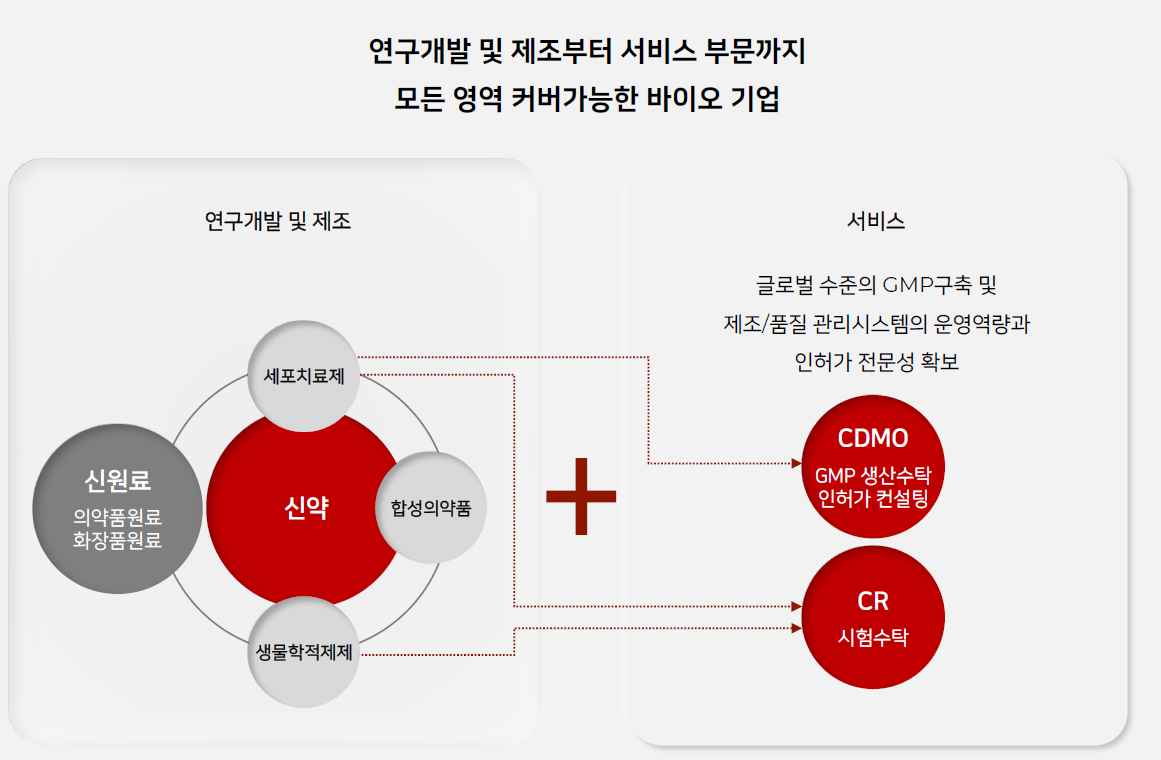
아미코젠이 케이뉴트라 건기식 완제품 생산과 ODM생산을 늘리기 위해 작년 증설완공한 문산 제3공장이 GMP인증받았다.
이번 증설로 인해 아미코젠의 연간 ODM 매출은 1000억원까지 가능해졌다.
케이뉴트라(KNUTRA)는 아미코젠의 헬스케어 전문브랜드로 대표제품은 먹는 콜라겐 제품이다. 아미코젠은 전매특허인 효소분해 공법으로 콜라겐을 원료소재부터 완제품까지 원스톱으로 제조할 수 있는 유일한 국내 기업이다.
하지만 작년 건기식 매출이 감소했는데, ODM매출은 소폭 늘었지만 케이뉴트라 매출은 급격히 하락한 것이 그 원인이다. 건기식에서 아직 아미코젠의 케이뉴트라는 브랜드파워가 없기에 이러한 결과가 나오는 것이다.
아미코젠은 비피도 인수로 인해 건기식 사업의 반전을 꾀하고 있는듯하다. 마이크로바이옴과 콜라겐에서 어떤 콜라보가 나올지 궁금하다.
코스닥 상장 바이오기업 아미코젠(대표 신용철)이 보유 공장의 추가 우수건강기능식품제조기준(이하 GMP) 인증을 획득했다. 이를 계기로 이 회사는 건강기능식품 사업을 확대할 계획이다.
7일 식품의약품안전처에 따르면 아미코젠은 최근 경상남도 진주시에 소재한 ‘문산 제3 공장’의 GMP 인증을 획득했다.
이에 따라 아미코젠이 보유한 GMP 공장은 총 3곳으로 늘어났다. 경남 진주시 진성면 소재 공장 한 곳은 2006년 인증을 받았다. 이어 이번에 세 번째로 인증을 받은 ‘문산 제3 공장’과 같은 진주시 문산읍 소재 ‘문산공장’은 2013년 GMP 인증을 획득했다. ‘문산 공장’이 GMP 인증을 받은 지 약 9년 만에 추가로 ‘문산 제3 공장’이 인증을 받게 됐다.
건강기능식품 사업 확대를 위해 추가로 GMP 인증을 획득한 것으로 분석된다. 아미코젠은 제약용 특수 효소와 건강기능식품 개발·생산 등을 주요 사업으로 하고 있다. 건강기능식품 사업은 크게 제조자개발생산(ODM)과 자체 브랜드 사업으로 나뉜다. 자체 브랜드 ‘케이뉴트라’는 2015년 출범했다.
지난해 3분기까지 건강기능식품 사업 매출이 전년동기 대비 지지부진했다. 이 회사 매출에서 건강기능식품 ODM 매출이 차지하는 비중은 약 3%, 자체 브랜드 매출이 차지하는 비중은 약 2%, 종속회사의 건강기능식품 매출이 약 5% 등이다. 회사 매출의 약 10% 정도가 건강기능식품 사업에서 발생하고 있는 것으로 추산된다. 이 모두를 포함한 건강기능식품 사업 매출은 지난해 3분기 누계 기준 약 92억원으로 전년동기 대비 44.6% 감소했다. ODM 사업 부문의 매출만 소폭 증가했을 뿐, 자체 브랜드 사업과 종속회사(아미코젠퍼시픽)을 통한 유통사업 매출은 감소했다.
올해는 자체 브랜드 사업 강화와 마이크로바이옴 기업 '비피도' 인수로 건강기능식품 사업 매출 증가를 꾀하고 있다. 아미코젠은 지난해 7월 마이크로바이옴 기업 비피도의 지분 약 30%(245만4000주)를 약 600억원에 취득해 경영권을 인수한 바 있다. 비피도는 마이크로바이옴 신약 연구개발, 프로바이오틱스 건강기능식품 사업 등을 하고 있다. 이 회사는 2006년 강원도 홍천군 소재 공장에 대해 건강기능식품 GMP 인증을 획득했다. 또 자체 브랜드 ‘케이뉴트라’는 SNS 마케팅을 강화하고 모바일 쇼핑앱을 출시하며 소비자 접근성을 높이고 있다.
회사 측은 “신종 코로나바이러스 감염증으로 인한 건강 염려군의 증가와 건강기능식품의 소비자 연령이 낮아지는 추세에 맞춰 SNS 마케팅 활동을 강화했고, 모바일 쇼핑앱을 출시했다”면서 “앞으로도 케이뉴트라는 온라인 쇼핑몰을 기반으로 모바일 라이브커머스를 강화하고, 편의점 및 H&B 전문샵등에 입점해 소비자와의 접점을 늘려갈 계획”이라고 설명했다.
https://www.ceoscoredaily.com/page/view/2022020315571131762
아미코젠, 문산3공장 건강기능식품 GMP 인증 획득
코스닥 상장 바이오기업 아미코젠(대표 신용철)이 보유 공장의 추가 우수건강기능식품제조기준(이하 GMP) 인증을 획득했다. 이를 계기로 이 회사는 건강기능식품 사업을 확대할 계획이...
www.ceoscoredaily.com
'주식 > 아미코젠' 카테고리의 다른 글
| 아미코젠, 2022년 1월 대표이사 월간 주주레터 리뷰 (0) | 2022.02.14 |
|---|---|
| 아미코젠, 송도 배지 공장 착공 승인 (0) | 2022.02.12 |
| 아미코젠, 시계는 2023년으로 맞추어져 있다! (0) | 2022.01.19 |
| 아미코젠, 2026년까지 바이오소재 국내점유율 30~40% 목표! (0) | 2021.12.24 |
| 아미코젠파마, 루게릭병 치료제 임상3상 디자인 (0) | 2021.12.16 |