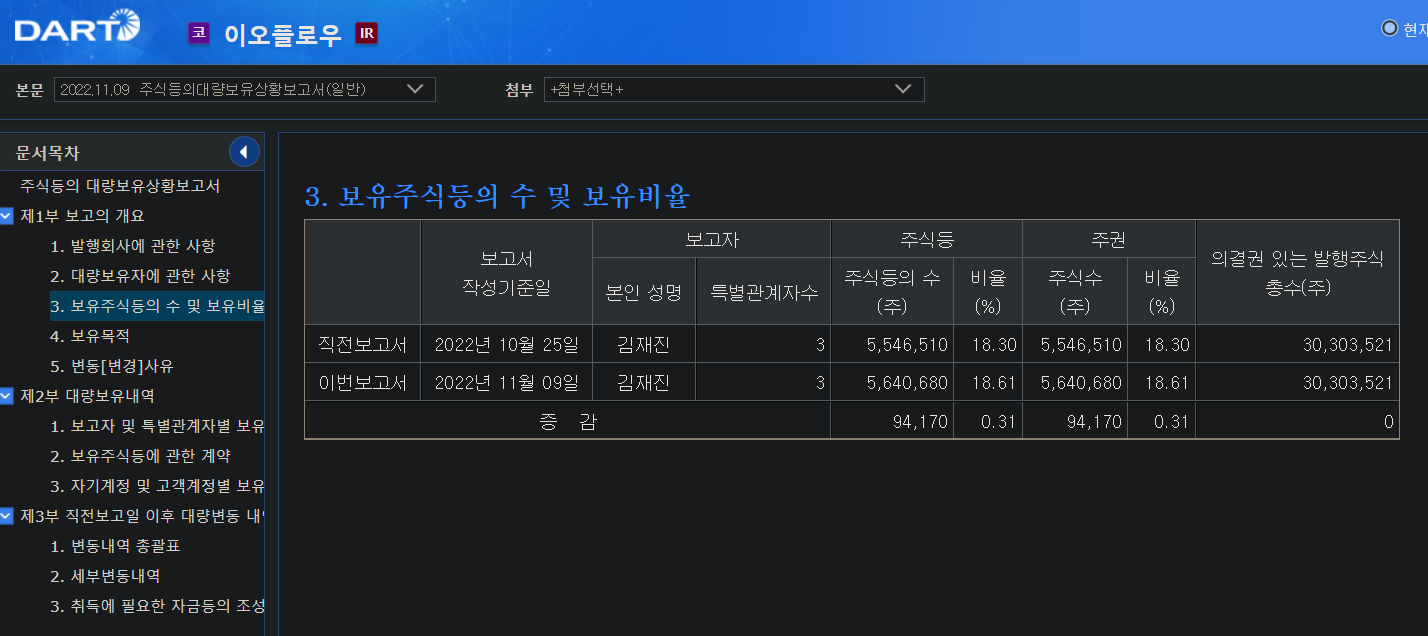
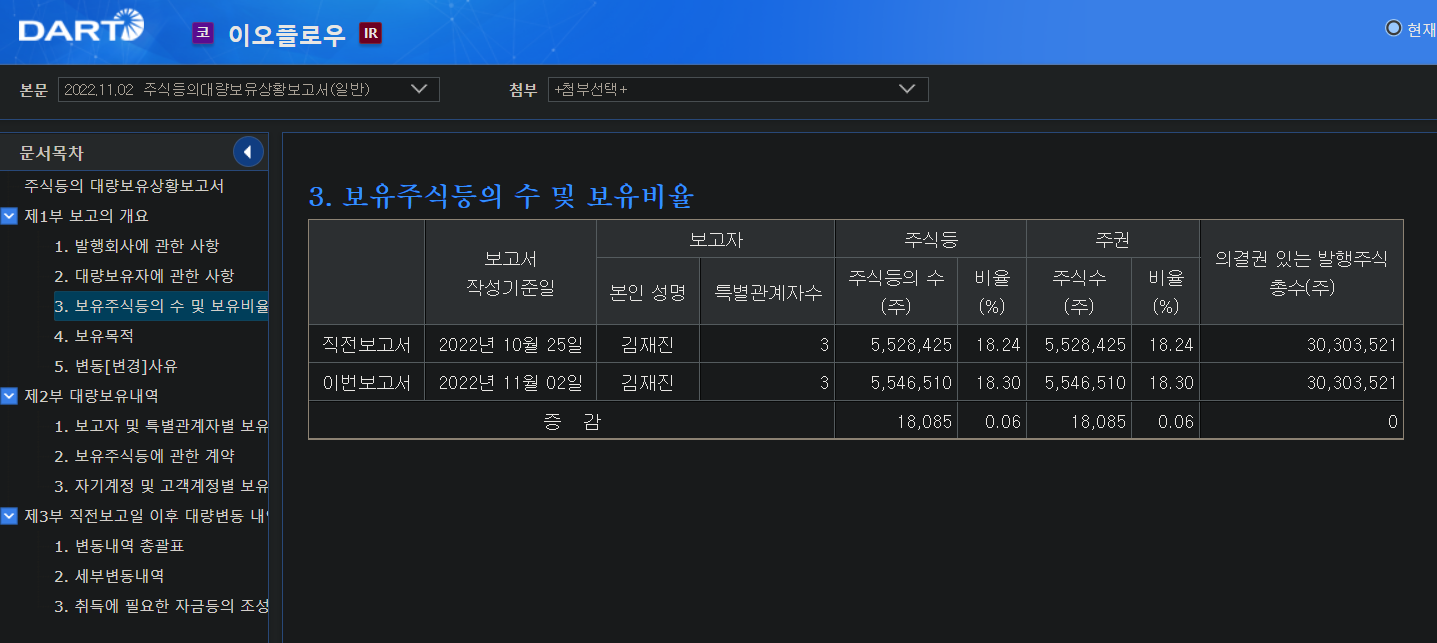
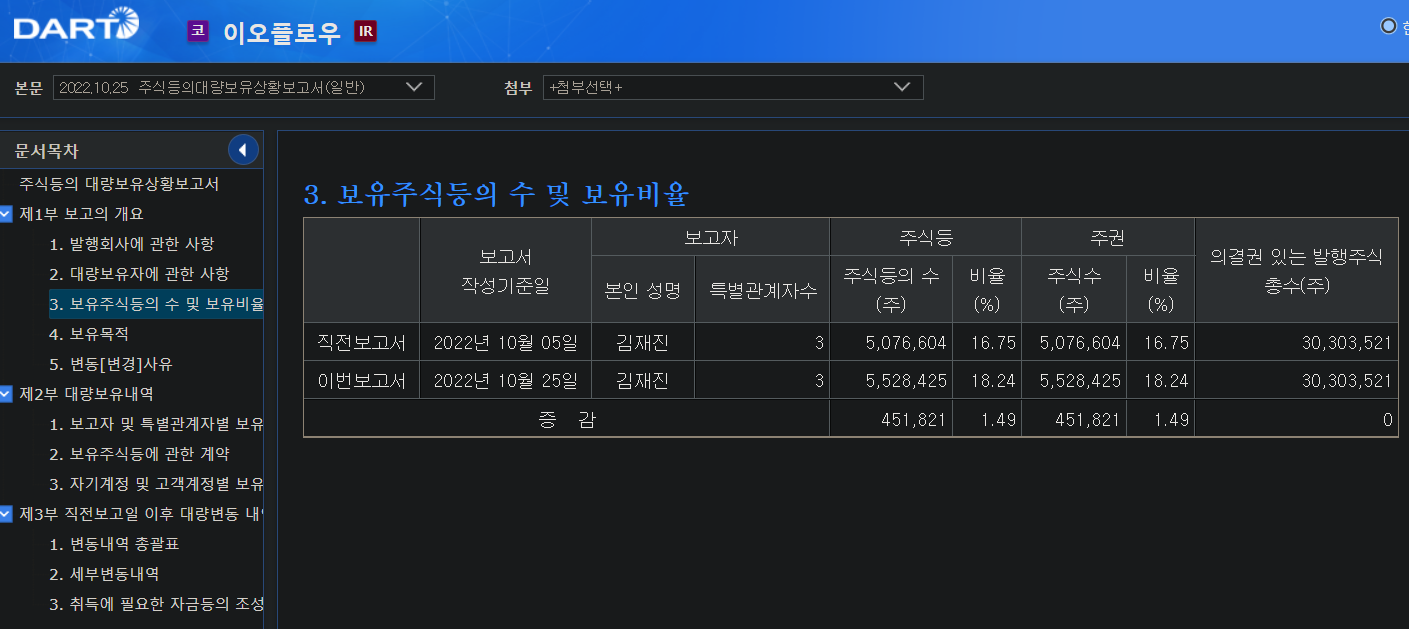
이오프롤우가 이오패치에 대해서 미국FDA 품목허가 신청했다.
이오패치는 국내는 물론 유럽CE도 받고 중동에서도 품목허가를 받은 이력이 있기 때문에 기술적으로는 큰 문제가 없기 때문에 품목허가에는 별차질없이 등록될 것으로 예상하며, 그 시기는 빨라야 올해말이 아닐까 한다.
이오플로우는 미국내 판매를 위해 글로벌 업체와 유통계약체결 협상을 하고 있는데, 이 것이 상반기 이오플로우의 최대 모멘텀이라고 생각한다.
이오플로우가 미국 FDA(식품의약국)에 웨어러블 인슐린 펌프 이오패치에 대한 품목허가를 신청했다고 27일 밝혔다.
이를 위해 이오플로우는 FDA 510(k)를 신청했다. 510(k)는 제품 시판 전 의료기기의 안전성과 유효성을 증명하는 프로그램이다. 미국에서 유통 및 판매하려는 제품을 기존 인증된 제품과 성능 등의 동등성을 비교해 검증한다.
그 동안 이오플로우는 이오패치에 대해 국내 식약처, 유럽 CE 인증, 아랍에미리트(UAE)와 인도네시아 품목허가까지 모두 받았다. 중국은 현지 파트너사와 합작사를 설립해 임상시험 및 인증신청을 준비하고 있다. 이오플로우 관계자는 "국내 시장에서 자리를 잡아가고 있는 만큼 적극적으로 해외 시장 진출에 나서고 있다"며 "미국은 전 세계 당뇨병 치료의 가장 큰 시장으로 인슐린 주입기 시장의 절반 가까이를 차지하고 있다"고 말했다.
김재진 이오플로우 대표는 "최근 세계 최초로 7일간 사용할 수 있는 웨어러블 펌프 개발을 공식화해 글로벌 헬스케어 시장에서 많은 주목을 받고 있다"며 "이오패치에 대한 글로벌 니즈가 상당히 높은 것을 확인한 만큼 이번 미국 시장 진출을 매우 기대하고 있다"고 밝혔다. 현재 이오플로우는 미국 유통망 확보를 위해 미국 뿐만 아니라 글로벌 유통망을 보유한 대형 업체들과 협의를 진행 중이며, 내년 상반기 유통계약 체결이 목표다.
한편 이오패치는 이오플로우가 미국 인슐렛(제품명 옴니팟)에 이어 지난해 세계에서 두 번째로 상용화에 성공한 일회용 웨어러블 인슐린 펌프다. 이오플로우 측은 이오패치가 경쟁사 제품보다 크기가 작고 가벼운 데다 인슐린 주입선이 짧아 사용 편의성이 높다고 강조한다. 교체주기가 3.5일로 경쟁사(3일) 대비 길다는 점도 내세운다. 가격이 같아도 시장 경쟁력은 충분하다는 전언이다.
회사는 인슐린펌프와 연속혈당센서를 일체화하는 통합형 웨어러블 인공췌장 솔루션 개발 계획으로 국내 의료기기 회사로서는 최초로 미국 FDA로부터 혁신의료기기 지정을 받은 바 있다. 지난달 22일에는 세계 최초로 최대 7일간 사용 가능한 3ml 일회용 웨어러블 인슐린 펌프 시제품 제작에 성공했다는 소식을 전했다.
https://news.mt.co.kr/mtview.php?no=2022122718035393583
이오플로우, 웨어러블 인슐린 펌프 '美 FDA' 품목허가 신청 - 머니투데이
이오플로우가 미국 FDA(식품의약국)에 웨어러블 인슐린 펌프 이오패치에 대한 품목허가를 신청했다고 27일 밝혔다. 이를 위해 이오플로우는 FDA 510(k)를 신청했다....
news.mt.co.kr
'주식 > 이오플로우' 카테고리의 다른 글
| 이오플로우, 다이아벨루프와 인공췌장솔루션 개발 협업! (0) | 2023.01.13 |
|---|---|
| 이오플로우, 곤지암신공장 유럽 GMP 인증 추진한다 (0) | 2023.01.12 |
| 이오플로우, 인슐렛보다 더 좋은 제품으로 시장을 노린다! (0) | 2023.01.09 |
| 이오플로우, 이오패치3.0으로 글로벌 시장 석권을 꿈꾼다! (0) | 2022.11.23 |
| 이오플로우, 코스닥150 편입 (0) | 2022.11.18 |