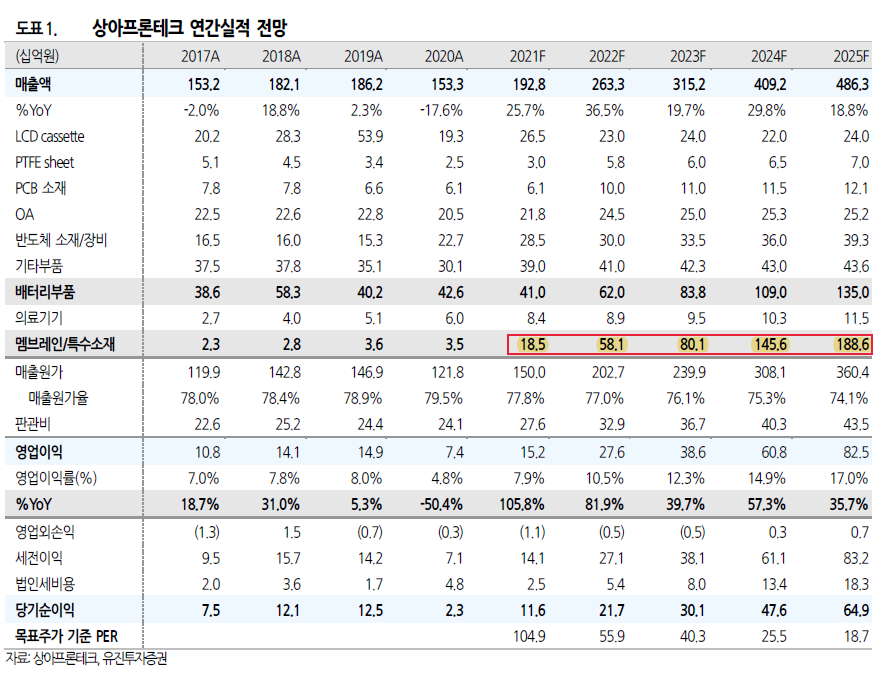
알테오젠이 2017년 6월 16일부터 시작한 ALT-P7 임상1상이 드디어 마무리되었다.
ALT-P7 임상1상은 표준치료에 실패한 진행성 또는 재발성 HER2 양성 유방암 24~48명의 환자를 대상으로 투약용량에 따라 8개 그룹으로 나누어 12주 동안 3주 간격으로 2회 이상 ALT-P7을 투여했다.
유효성 평가 결과 질병관리율은 72.00%(25명 중 18명), 최대내약용량(MTD)은 4.5mg/kg, 용량제한독성(DLT)은 11.11%(27명 중 3명)으로 나타났다.
임상2상에서의 최대내약용량(MTD)과 권장용량(RP2D)은 4.5 mg/kg로 정해졌다.
오늘 공시는 기존에 알던 정보와 크게 다를바가 없어서 시장도 반응하지 않았다.
ALT-P7의 가치는 임상2상에 들어가고 그에 따른 결과가 나와야지 시장에서 인정해줄 것 같다.
알테오젠의 주가는 여전히 고점 대비 많이 빠진 상태다. 그야말로 골이 깊다. 이 골을 상방으로 전환시키는 계기가 필요하다. 그것은 ALT-B4의 기술수출 진행상황에 달려있다.
.
투자판단 관련 주요경영사항
| 1. 제목 | HER2 양성 유방암 대상자 중 표준 치료에 실패한 전이를 가진 진행성 또는 재발성 환자에게 ALT-P7을 주사제로 투여하여 안전성, 약동학, 항암효과를 평가하는 국내 임상1상 시험결과 | |
| 2. 주요내용 | 1) 임상시험 제목 - HER2 양성 유방암 치료제(ADC: ALT-P7) 국내 임상 1상 시험 결과 2) 임상시험 단계 - 국내 임상시험 제 1상 3) 대상질환명(적응증) - 표준치료에 실패한 진행성 또는 재발성 HER2 양성 유방암 4) 임상시험 신청(승인)일 및 승인(시험)기관 - 신청일 : 2016년 12월 09일 - 승인일 : 2017년 06월 16일 - 임상승인기관 : 국내 식품의약품안전처(MFDS) - 임상시험기관 : 국내 2개 기관 5) 임상시험 등록번호 - NCT03281824 6) 임상시험의 진행경과 - 목적: HER2 양성 유방암 대상자 중 표준 치료에 실패한 전이를 가진 진행성 또는 재발성 환자에게 ALT-P7을 주사제로 투여하여 안전성, 약동학, 항암효과를 평가 - 계획: 공개, 단일군, 단계적 증량 시험 - 실시기간: 2018년 1월 11일 ~ 2021년 1월 15일 - 방법: 1. 대상 환자 규모: 총 8개 용량군 24~48명 2. 실시기간: 약 12주 이상 3. 실시방법: 3주(21일) 간격 2회 이상 투여 7) 임상시험 결과 1. 안전성 결과 - 최대내약용량(MTD) 및 임상2상 권장용량(RP2D): 4.5 mg/kg - 용량제한 독성(DLT): DLT는 11.11%(3/27명), 모두 ALT-P7 4.8 mg/kg 에서 열성호중구감소증(febrile neutropenia), 고빌리루빈혈증(hyperbilirubinemia), 근육통(myalgia), 저나트륨혈증(hyponatremia)이 관찰되었음 - 약동학 평가: 용량의존적으로 혈중 ALT-P7 수치가 증가 양상이 관찰되었음 - 면역원성 평가: 본 임상 1상시험에서 ALT-P7에 대하여 면역원성을 보이는 대상자는 없었음 2. 유효성 결과 - 질병관리률(DCR=CR+PR+SD): 72.00%(18/25명) - 최대내약용량 4.5 mg/kg 인 Cohort 7 에 참여한 3명의 무진행생존기간(PFS): 6.67±4.01 개월 8) 기대 효과 - ALT-P7은 HER2 분자를 표적으로 하는 약물접합 표적 항암치료제로서, 항체의 C 말단에 위치 특이적으로 약물을 접합 [Drug-Antibody Ratio (DAR): 2]한 형태로 위치특이적 접합 기술 중 가정 간편하고 생산 수율이 높은 기술임 - 항원-항체 반응성에 영향이 없으며, 항체의 구조적 안정성을 저해하지 않아 매우 안정한 치료제임 - 이번 First-in human 임상 1상 시험을 통하여 ALT-P7 의 최대 내약용량 및 그 안전성/유효성을 확인하였으며, 후속 임상에서 임상 2상 권장 용량의 탁월한 효능을 보일 것으로 기대됨 9) 향후 계획 - 임상1상에서 안전성이 확인된 용량에 대한 효능평가를 위한 임상 2상 검토 10) 기타 사항 - 전세계적으로 매년 2백만명이상의 새로운 유방암 환자들이 발생하고 있으며, HER2 양성 환자들이 전체 유방암 환자의 80%이상을 차지하고 있음 - HER2 양성 유방암 시장규모는 2021년 23조원 규모가 예상되며, 매년 10% 이상 성장세를 보이고 있음 - HER2 양성 유방암에 대한 다양한 치료 약물 개발에 따른 환자의 기대수명이 증가하고 있으며, 이에 따라 표준 치료에 실패한 대상환자수가 지속적으로 증가할 것으로 판단됨 - 표준 치료에 실패한 이들 환자들에 대해 확인된 안전성을 바탕으로 추가 임상 계획을 수립할 예정임 |
|
| 3. 사실발생(확인)일 | 2021-08-03 | |
| 4. 결정일 | - | |
| - 사외이사 참석여부 | 참석(명) | - |
| 불참(명) | - | |
| - 감사(사외이사가 아닌 감사위원) 참석여부 | - | |
| 5. 기타 투자판단과 관련한 중요사항 | ||
| - 상기 확인일자는 당사가 CRO로부터 임상 1상 Topline data 수령일 입니다. ※ 투자유의사항 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 상존합니다. 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자 위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다. |
||
| ※ 관련공시 | 2017-06-19 투자판단 관련 주요경영사항 |
|
'주식 > 알테오젠' 카테고리의 다른 글
| 알테오젠, ALT-P7 가치는 7조8000억원의 엔허투와 유사 (2) | 2021.08.08 |
|---|---|
| 알테오젠, 아일리아 바이오시밀러인 ALT-L9의 국내 임상 1상 종료 (0) | 2021.08.06 |
| 알테오젠, 5년 내로 매출2조원을 꿈꾼다 (0) | 2021.08.01 |
| 알테오젠, 아스트레제네카의 임핀지는 ALT-B4가 절실히 필요하다(Feat. 현대차증권) (0) | 2021.07.12 |
| 알테오젠, ADC 난소암 치료제 핵심기술인 항체 국내특허등록 (0) | 2021.07.07 |