요즘 알테오젠 주가가 좋지 않은 사유는 미국 상하원 의원 몇몇이 제기한 머크의 키트루다 특허 연장 조치 반대 목소리 때문이다.
주장의 요지는 다음과 같다.
1. 특허의 존속기간은 20년으로, 키트루다는 28년에 특허가 만료된다.
2. 하지만 키트루다SC 특허로 인해 실질적으로 특허존속기간이 20년이 아닌 35년이 된다.
3. 그로 인해, 바이오시밀러 진입시기가 늦춰지게 되어 약가 부담이 문제다. 오히려, 키트루다 가격은 100% 이상 상승했다.
이 문제는 알테오젠 투자리스크 중에서 전혀 고려하지 않던 문제다.
최선의 시나리오는 미국은 로비의 나라이므로, 빅팜인 로슈와 머크 등이 합세하여 이 이슈를 무마시키면 된다. 미국에서 이런 이슈는 많다. 하지만 모든 사안들이 통과되는 것이 아니다. 이 이슈도 그 중 하나에 불과하다. 즉, 사소한 노이즈로 해결될 가능성이 크다.
최악의 시나리오로 키트루다SC로 특허연장이 안된다면, 머크는 문제가 된다. 키트루다의 독점권을 상실하기 때문이다. 하지만 알테오젠은 머크만큼의 문제는 없을 것이다. 키트루다SC 매출이 줄어들게 되어, ALT-B4 원재료 매출이 줄어드는 것 이외에 다른 문제는 없어보인다. 키트루다SC는 일단 출시할 것이므로, 알테오젠의 ALT-B4는 안정성과 효능을 입증하여, 할로자임과 동일지위에 오를 것이다.
그리고 바이오시밀러 시장은 특허연장 이슈와는 전혀 상관이 없다. 바이오시밀러SC는 알테오젠만이 진입할 수 있는 시장이다.
현재 시장의 우려는 머크의 키트루다SC에 대해 너무 초점을 맞춘 것으로 보인다. 하지만 알테오젠의 가치는 오리지널 의약품만이 아닌 바이오시밀러까지도 확장가능한 확장성이 중요한 포인트다.
연매출 26조원에 달하는 면역항암제 ‘키트루다’(Keytruda)에 대한 특허 기간 연장 가능성이 나오면서 반대 목소리가 나오고 있다.
27일 한국바이오협회 바이오경제연구센터에 따르면, 최근 미국에서 몇몇 상·하원 의원들이 미국제약사 머크의 키트루다에 대한 특허 연장 조치를 반대하며 이를 조사해달라고 나섰다.
의약품의 경우 특허권자 권리를 보호하기 위해 특허기간이 존속하는 동안 복제약(제네릭) 시판이 금지된다.
지난 22일 미국 엘리자베스 워렌 상원의원은 미국 특허청(PTO)에 서한을 보내 전 세계 최대 매출 항암제인 키트루다의 특허 연장 조치에 대해 조사해야 한다고 촉구했다. 여기에는 버나드 샌더스 상원의원과 캐티 포터 하원의원, 프라밀라 자야팔 하원의원도 함께 서명했다.
키트루다는 2014년 9월 최초로 흑색종 치료제로 미국 식품의약국(FDA)으로부터 허가를 받은 뒤 현재 18개 암종에 쓰이고 있다. 지금까지 53개의 특허가 등록됐으며, 추가로 129개의 특허가 출원된 상태이다.
그러나 워렌 상원의원 등은 머크가 키트루다 피하제형에 대한 특허까지 출원할 경우 최소 수년간 특허기간이 연장될 것으로 보고 우려하고 있다.
키트루다는 미국 특허청에 추가적인 특허 등록이 없을 경우 관련 핵심 특허는 오는 2028년 종료될 예정이다. 반면 미국 특허청에 새로운 특허가 등록된다면 키트루다 바이오시밀러(바이오의약품 복제약) 시장 진입은 2036년 이후에나 가능할 전망이다.
이렇게 되면 키트루다는 35년이라는 긴 특허 독점기간을 부여받게 된다.
워렌 상원의원은 제약사들이 약의 형태나 구조를 조금씩 바꿔 관련 후속 특허를 지속적으로 추가함으로써 특허권을 방어하는 전략인 특허 애버그리닝(evergreening), 특허 덤불(patent thickets) 등과 같은 특허시스템을 악용해 광범위한 반경쟁적 실태가 벌어지고 있다고 지적하고 있다. 키트루다의 경우 실제로 관련 없는 적응증과 제형 특허 출원이 전체의 74%에 달한다고 꼬집었다.
특허 무효 소송도 쉽지 않다. 미국지식재산변리사협회 조사에 의하면, 단일특허에 대한 특허소송비는 최대 400만 달러(약 53억원)가 소요되며, 블록버스터 의약품은 보통 수십 개의 특허로 보호되기 때문에 소송비용이 크게 늘어 결국 제네릭(복제약) 및 바이오시밀러의 진입이 늦어질 수밖에 없다.
워렌 상원의원은 “키트루다는 출시된 지 5년 만에 약가가 147% 상승했다”고 지적하며, 환자의 재정 부담이 증가하고 있다고 비판했다. 현재 키트루다 연간 약가는 16만5308 달러(한화 약 2억원)에 달한다.
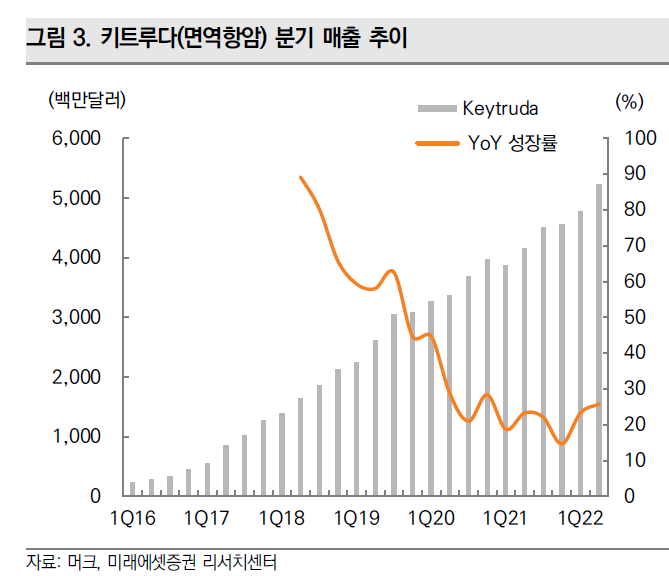
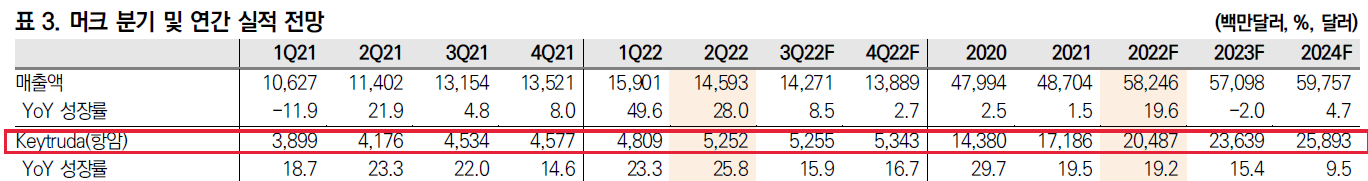
지난 2일 머크 결산보고서에 따르면, 머크 전체 매출은 전년 대비 22%가 증가한 593억 달러(약 78조원)를 기록했다. 키트루다 매출도 전년 대비 22% 증가한 209억 달러(약 26조원)에 달했다. 키트루다는 머크 전체 매출에서 차지하는 비중이 35.2%에 달하는 가장 중요한 품목이다. 키트루다는 국내에서도 작년 기준 매출 2400억원을 기록했다.
이에 자가면역질환 치료제 ‘휴미라’ 이후 세계 최대 매출 의약품으로 떠오르고 있는 키트루다 특허에 대해 미국 특허청이 어떤 조치를 취할지, 피하주사 제형 특허 등 키트루다에 새롭게 추가되는 특허가 현재 2028년까지인 특허기간에 어떤 영향을 미칠지 등이 주목되고 있다.
바이오경제연구센터 관계자는 “이와 함께 키트루다가 미국 정부 인플레이션감축법(IRA)에 따른 약가 인하 대상에 포함될지 등에 따라 키트루다의 시장 독점 및 경쟁 상황이 크게 바뀔 수 있는 만큼 머크와 미국 정부 및 의회, 바이오시밀러 기업들의 관심이 높아지고 있다”고 분석했다.
https://newsis.com/view/?id=NISX20230227_0002207719&cID=10434&pID=13200
매출 26조 항암제 ‘키트루다’…美의원들 "특허연장 반대"
[서울=뉴시스]황재희 기자 = 연매출 26조원에 달하는 면역항암제 ‘키트루다’(Keytruda)에 대한 특허 기간 연장 가능성이 나오면서 반대 목소리가 나오고 있다
www.newsis.com
'주식 > 알테오젠' 카테고리의 다른 글
| 알테오젠, 신규 이사선임으로 회계 강화 (0) | 2023.03.17 |
|---|---|
| 알테오젠, 키트루다SC 특허는 2036년까지 보호가능! (0) | 2023.03.10 |
| 알테오젠, 소송 등의 제기ㆍ신청(경영권 분쟁 소송) 공시 (0) | 2023.03.02 |
| 알테오젠, ALT-L9 글로벌 임상3상 환자모집 완료! (0) | 2023.02.26 |
| 알테오젠, 풀리지 않는 숙제 (1)공장 (2)알토스바이오 (1) | 2023.02.18 |