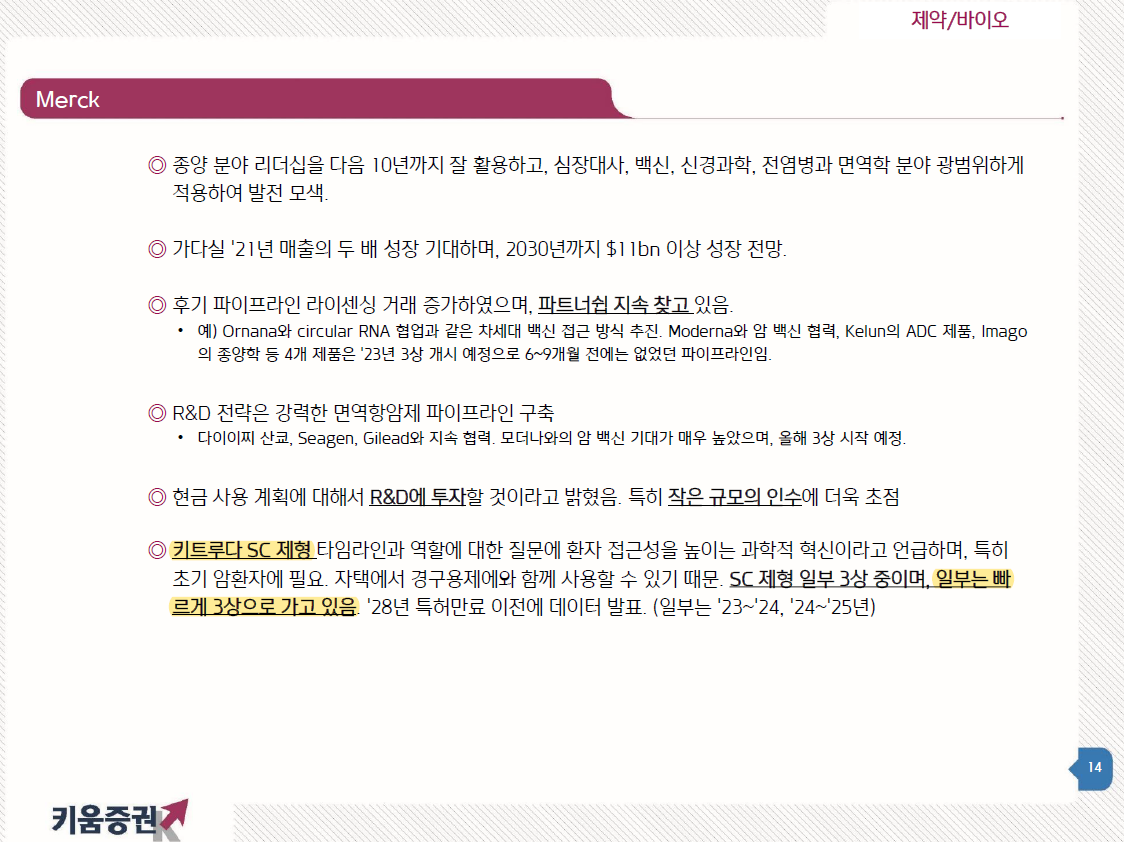
리제네론이 아일리아 특허 만료를 앞두고 아일리아 바이오시밀러 개발 선두 업체들을 대상으로 특허소송을 시작하고 있다.
물질 특허는 내년을 시작으로 2025년까지 다 만료되지만 제형, 제법특허는 만료까지 시간이 더 남아있다. 아일리아 바이오시밀러를 개발하더라도 언제라도 특허소송에 휘말릴 수 있으니 출시 후에 추가로 대응전략이 필요한 셈이다.
하지만 알테오젠은 고유의 제형, 제법특허를 보유하고 있어서 다른 업체들보다 특허소송에서 자유롭다. 알테오젠의 임상3상이 가장 늦지만 걱정되지 않는 이유가 이 때문이다.
미국 제약사 리제네론이 글로벌 매출 13조원 규모의 황반변성 치료제 블록버스터 ‘아일리아(성분명 애플리버셉트)’의 특허 만료를 앞두고 국내 업체를 상대로 소송을 제기했다. 아일리아의 물질 특허는 내달 미국에서, 내년 1월에는 한국에서, 2025년 5월이면 유럽에서 만료를 앞두고 있다. 아일리아 바이오시밀러(바이오 복제약) 개발을 둘러싼 새로운 특허 전쟁의 서막이 올랐다.
18일 금융감독원 전자공시스템에 따르면 아일리아를 개발한 글로벌 제약사 리제네론이 지난 1월 16일 서울중앙지법에 삼성바이오에피스와 삼성바이오로직스(779,000원 ▼ 1,000 -0.13%)에 대한 특허권 침해금지와 예방 청구소송을 제기했다.
황반변성은 노화로 생기는 대표적 안질환이다. 황반은 빛과 색을 선명하게 인식하는 기관인데, 노화에 따라 황반에 새로운 혈관들이 생기는 식으로 퇴화되면 시력을 잃게 된다. 아일리아는 혈관내피성장인자를 차단해 황반에 혈관이 새로 생기는 것을 막아서 퇴화를 늦춘다. 아일리아는 지난해 글로벌 매출 102억 달러(약 13조 4000억원)을 기록한 블록버스터 의약품으로, 미국 시장 매출만 8조원(60%)을 차지한다. 이 의약품은 고령화로 매출이 매년 늘어나고 있다. 내달 미국 특허 만료를 앞두고 전세계 바이오시밀러 제약사들이 눈독을 들이는 이유다.
아일리아를 둘러싼 글로벌 특허 전쟁은 이미 시작됐다. 리제네론은 지난해 비아트리스를 상대로 24개 특허 침해 소송을 제기했다.
이번 소송은 아일리아의 한국에 출원한 특허에 대해서만 한정된다. 리제네론은 지난 2013년 한국에서 아일리아의 물질 특허를 등록했는데 이 특허 만료일이 내년 1월로 다가왔다. 리제네론은 작년 10월 삼성바이오에피스를 상대로 특허심판원에 아일리아에 대한 권리범위확인 심판을 청구했다.
특허 소송은 바이오시밀러를 개발하는 제약사들이 최종 시판을 위해 넘어야 할 가장 큰 산으로 통한다. 약을 시장에 내놓으려면 당국의 품목허가를 먼저 받아야 하지만, 이 관문을 통과하더라도 의약품에 엮인 특허를 뚫지 못하면 환자에게 쓸 수가 없기 때문이다.
오리지널 제품을 생산한 기업들은 특허 보호기간을 연장하기 위해서 특허 소송을 자주 활용한다. 기업 소송은 최종 결론이 나올 때까지 2년 이상의 기간이 걸리기 때문이다. 지난해 국내에서 아일리아의 매출은 804억원으로, 글로벌 시장이 13조원이라는 점을 감안하면 매우 작은 시장이다.
리제네론이 그런데도 국내 특허까지 걸고 넘어지는 것은 삼성바이오에피스를 비롯한 국내 제약사와 바이오 기업을 위협적으로 보고 바이오시밀러 개발을 저지하려는 포석으로 보인다. 전세계 시장에서 아일리아 바이오시밀러로 허가받은 의약품은 아직 없다.
현재까지 화이자의 바이오시밀러 사업 부문을 분사해 설립한 비아트리스(옛 마일란)가 개발한 후보물질이 미 식품의약국(FDA)에 품목 허가를 신청하며 가장 앞서 있다. 비아트리스 다음으로 삼성바이오에피스의 개발 속도가 가장 빠르다.
삼성바이오에피스는 지난달 미국에서 열린 미국시력안과학회(ARVO)에서 아일리아 바이오시밀러 후보물질(SB15) 임상 3상 결과를 공개했다. 비아트리스는 작년 7월 미국망막학회에서 임상 3상 결과를 공개했다.
이밖에 셀트리온(173,900원 ▲ 1,800 1.05%), 삼천당제약(64,400원 ▲ 400 0.63%), 알테오젠(47,200원 ▲ 3,100 7.03%)이 개발에 나선 것으로 파악된다. 셀트리온은 지난 4월 글로벌 임상 3상 중간 결과를 공개했고, 삼천당제약은 지난 3월 글로벌 임상 3상 결과를 공개했다. 알테오젠은 올해 임상 3상에 돌입했다. 미국 제약사인 암젠은 올해 1월 임상 3상을 마쳤고, 산도스는 이번 달 임상 3상을 마칠 예정이다.
다만 업계는 지난해 출시한 황반변성 이중항체 신약 ‘바비스모’를 태풍의 눈으로 보고 있다. 바비스모는 로슈가 개발한 신약으로 지난해 2월 미국 FDA(식품의약국)에서 허가를 받았다. 이 약은 아일리아의 핵심이 되는 혈관내피성장인자에 더해 안지오포이에틴-2(Ang-2)이라는 노화를 자극하는 인자를 차단해 효과가 좋다는 평가가 있다.
투약 간격도 4개월로 연장해 환자 부담도 적다. 아일리아는 첫 3개월은 한 달에 한번, 그 후에는 두 달에 한 번씩 주사를 맞아야 하는데, 바비스모는 넉 달에 한번만 맞으면 된다. 바비스모가 출시 첫해인 지난해 6억800만 달러(약8000억원)의 매출을 기록했다.
시장 규모 점점 커지는 블록버스터 안과 치료제 ‘특허戰’ 막올랐다
시장 규모 점점 커지는 블록버스터 안과 치료제 특허戰 막올랐다 美 리제네론, 서울중앙지법에 특허 소송 제기 아일리아 글로벌 시장 13조, 한국 시장 804억 삼성바이오에피스 바이오시밀러 견제
biz.chosun.com
'주식 > 알테오젠' 카테고리의 다른 글
| 알테오젠, 하이브로자임 플랫폼을 강화시키는 중 (0) | 2023.05.25 |
|---|---|
| 알테오젠, 꾸준한 인력증가=꾸준한 성장 (0) | 2023.05.24 |
| 알테오젠, 바이오USA에서 5개 기업와 기술이전 미팅 계획! (0) | 2023.05.18 |
| 알테오젠, 지속적 인력 충원 = 사업 순항중 (0) | 2023.05.06 |
| 알테오젠, 테르가제 매출액만 2000억원 이상 예상된다! (2) | 2023.04.30 |