안녕하세요, 바티입니다.
🤩아래 종목과 산업에 투자하시는 분들은 좋은 의견 나누며, 다 같이 부자되었으면 합니다..
✅ 규칙
- 정원 : 1000명
- 기본적으로 무료채팅방이며, 우선입장을 원하는 분은 별도 문의 @BatiInvestment
- 입장
①입장신청일로부터 2일 후 승인
②정원이 다 찼을 경우 미활동인원 정리 또는 자발적 퇴장 인원 발생시 순차적 승인
- 강퇴
①홍보, 욕설, 반말, 비하, 선동 및 일주일 이상
미접속시 강퇴
②규정위반시 참여중인 모든 채팅방 일괄 강퇴
- 기타
①정원 Full일 경우, 비공개로 전환
②밑줄 친 방은 현재 정원Full
📈모든 주식 채팅방
바티인베스트: https://t.me/BatiInvestChat
📈개별종목 채팅방
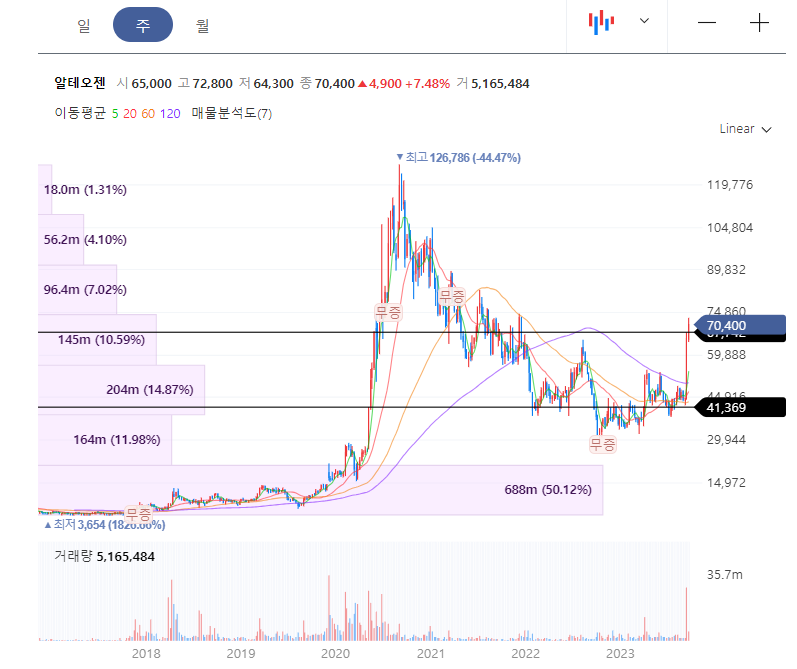
알테오젠: https://t.me/+vf8fpesGl-AwNjI9
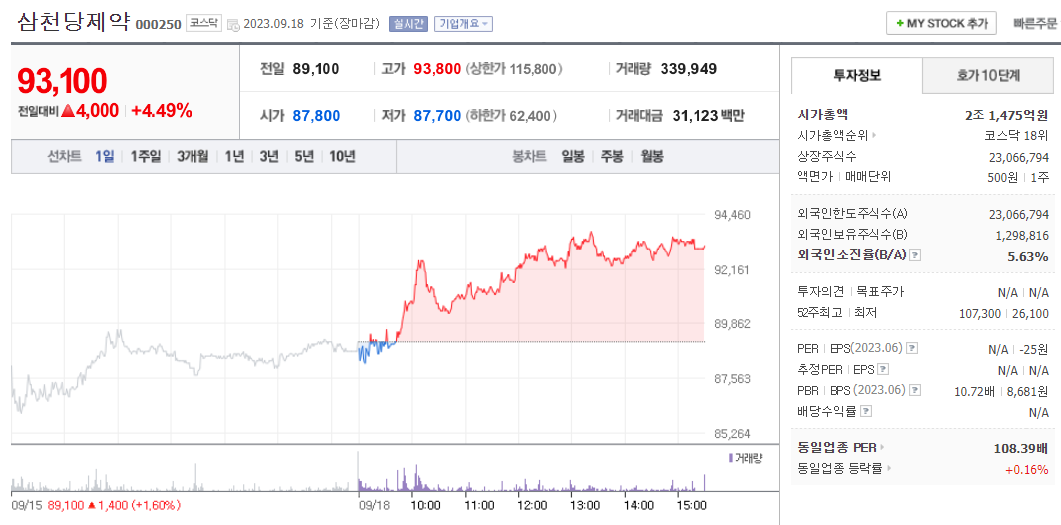
삼천당제약: https://t.me/+stG8Zfwl_eQ4MGU1
리가켐바이오: https://t.me/ligachembiochat
루닛: https://t.me/lunitChat
마이크로디지탈: https://t.me/MicrodigitalChat
바이오다인: https://t.me/biodynechat
보로노이: https://t.me/VRNoiChat
에스바이오메딕스: https://t.me/sbiomedicschat
에스티팜: https://t.me/stpharmchat
에이비엘바이오: https://t.me/ABLbioChat
에이프릴바이오: https://t.me/aprilbioChat
오름테라퓨틱: https://t.me/orumChat
젬백스: https://t.me/GemvaxChat
지아이이노베이션: https://t.me/GIInnovationChat
큐리옥스바이오시스템즈: https://t.me/curioxchat
코아스템켐온: https://t.me/corestemChat
케어젠: https://t.me/caregenChat
파마리서치: https://t.me/pharmaresearchChat
펩트론: https://t.me/peptronchat
한올바이오파마: https://t.me/hanallChat
이오플로우: https://t.me/eoflowchat
아미코젠: https://t.me/+F8MFbE1jIKEzOGNl
엘엔케이바이오: https://t.me/+AD2EsUsaAP43NjA1
📈산업 채팅방
바이오: https://t.me/Kbiochat
2차전지: https://t.me/evbattery
조선: https://t.me/shipbuildingchat
신재생: https://t.me/renewenergychat
반도체/IT: https://t.me/Ksemiconchat
엔터: https://t.me/Kenterchat
로봇: https://t.me/Krobotchat
뷰티: https://t.me/Kbeautychat
'바티인베스트' 카테고리의 다른 글
| 2020년 4분기 포트폴리오 (0) | 2020.12.02 |
|---|---|
| 꾸준함의 중요성 (0) | 2020.04.15 |
| 해외자산 리포트 2019년 1분기 (0) | 2019.03.29 |
| 바티의 "2019년 목표" (0) | 2019.02.26 |
| 바티 투자 리포트 1.1 (1) | 2018.11.14 |