ALT-B4 생산을 위한 CMO 선정을 알테오젠에게 또 요청했고 알테오젠이 이번에 선정완료했다.
머크가 키트루다SC 임상3상 성공에 대해 확신을 갖고 있는 듯하다.
바이오 플랫폼 기업 알테오젠이 안정적인 글로벌 공금망 확보를 위한 선제적인 대응에 나섰다.
알테오젠은 SC(피하주사) 제형변경 플랫폼에 사용하는 히알루로니다제 ‘ALT-B4’ 생산을 위한 추가 위탁생산 공장을 선정 완료했다고 18일 밝혔다.
알테오젠 관계자는 “이번 선정을 통해 알테오젠은 좀 더 안정적인 글로벌 공급망을 확보할 수 있게 됐다”며 “이를 통해 하이브로자임(HybrozymeTM) 플랫폼 기술이 적용된 피하제형 치료제들의 시판 전 안정적인 히알루로니다제 공급망을 확보하게 됐다”고 말했다.
알테오젠은 지난해 7월 위탁생산 공장 추가를 파트너사로부터 요청 받은 후, cGMP(미국 우수의약품제조품질관리기준) 수준의 생산관리 등 조건에 따라 위탁생산업체를 선정해왔다. 효과적인 생산을 위해 글로벌 공급망에 대한 경험을 가진 파트너사와 구체적인 최종 후보군을 정한 후 현장 실사에 나서 업체를 선정했다.
알테오젠 관계자는 “파트너사가 임상 3상을 진행하면서 하이브로자임 플랫폼에 대해 확신을 갖고 상업화에 대한 준비 요청을 지속적으로 하고 있다”며 “이번 과정을 통해 선정된 업체와 계약을 체결하고 지난번과 동일하게 파트너사와 기술이전 등을 포함한 용역 계약을 체결해 양산을 위한 준비를 할 계획”이라고 말했다.
알테오젠은 글로벌 파트너사들의 임상 진행에 맞춰 연구산출물의 체계적 품질 관리를 위한 ISO 9001 인증 취득, 품질 본부를 신설해 상업용 히알루로니다제의 양산을 준비하는 등 노력을 기울이고 있다.
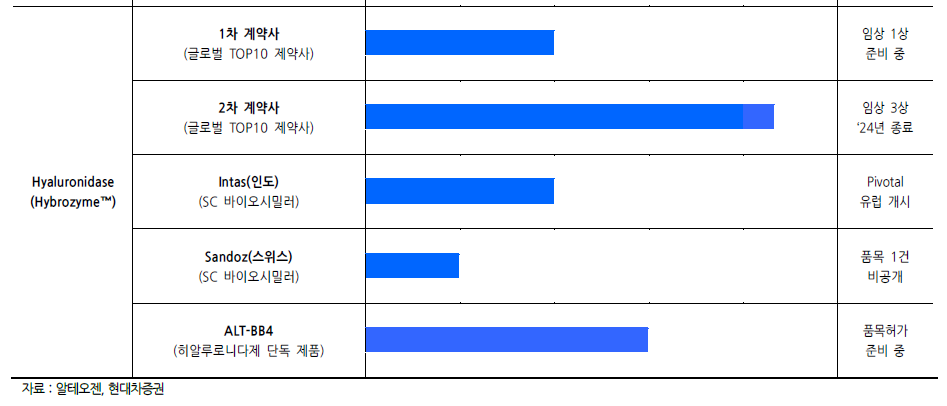
한편 알테오젠은 히알루로니다제를 사용한 피하제형 변경 플랫폼 기술 ‘하이브로자임’을 개발해 현재까지 총 4개의 글로벌 기업과 기술수출을 체결했다. 다수 글로벌 회사들과 MTA(물질 이전 계약서)를 맺고 타당성 조사를 수행 중이다. 현재 품목허가를 위한 임상시험을 진행하고 있는 두 제품의 조속한 상업화를 기대하고 있다.
https://www.newsis.com/view/?id=NISX20240118_0002596350&cID=10434&pID=13200
알테오젠, '히알루로니다제' 추가 위탁생산공장 선정 완료
[서울=뉴시스]황재희 기자 = 바이오 플랫폼 기업 알테오젠이 안정적인 글로벌 공금망 확보를 위한 선제적인 대응에 나섰다
www.newsis.com
'주식 > 알테오젠' 카테고리의 다른 글
| 알테오젠, 머크를 머크라고 불렀다! (0) | 2024.02.22 |
|---|---|
| 알테오젠, 여러 계약들이 다 마무리 단계! (1) | 2024.01.28 |
| 알테오젠, ALT-L9도 이제 합류한다! (1) | 2024.01.10 |
| 알테오젠, 테르가제 출시는 24년 상반기 예상! (1) | 2023.12.06 |
| 알테오젠, 연말선물로 머크와의 독점계약+추가 L/O를 기대해보자! (3) | 2023.11.27 |