5월 17일에 실시한 테고사이언스 IR자료를 읽어보자.
테고사이언스는 세포치료제 개발 및 생산 경험을 살려서 작년에 CDMO사업에 진출했다. CDMO사업으로 연간 매출 100억이 목표다. 기존 매출이 80~90억인데 기존매출만큼의 CDMO사업으로 벌겠다는 것이다.
테고사이언스는 기술력도 있고, 가격경쟁력도 있는데 CDMO 수주가 안되는 것은 영업력이 부족하다고 본다. 테고사이언스는 과거부터 봐왔지만 마케팅력이 부족하다.
GMP Capa는 아직 54%s남아있는데 작년에 셀라퓨틱스 바이오의 첫 수주 이후로는 아직 소식이 없다.

테고사이언스는 이제 회전근개파열 치료제 파이프라인만 봐야 한다.
회전근개파열 시장은 2024년에 글로벌 15조에 달하는 큰 시장이며 국내 시장은 5000억 규모다.
현재 회전근개파열을 치료하는 약은 없다.
타사가 가진 의약품이나 임상중인 의약품도 근본적인 치료제가 아닌 기능개선에 불과하다. 하지만 테고사이언스의 회전근개파열 치료제는 회전근개재생을 한다.
15조원 시장에서 유일한 치료제가 될 수 있는 것이다.

자가유래 회전근개파열 치료제인 TPX-114는 내년에 출시하고, 동종유래 회전근개파욜 치료제인 TPX-115는 2024년에 시장에 출시한다.
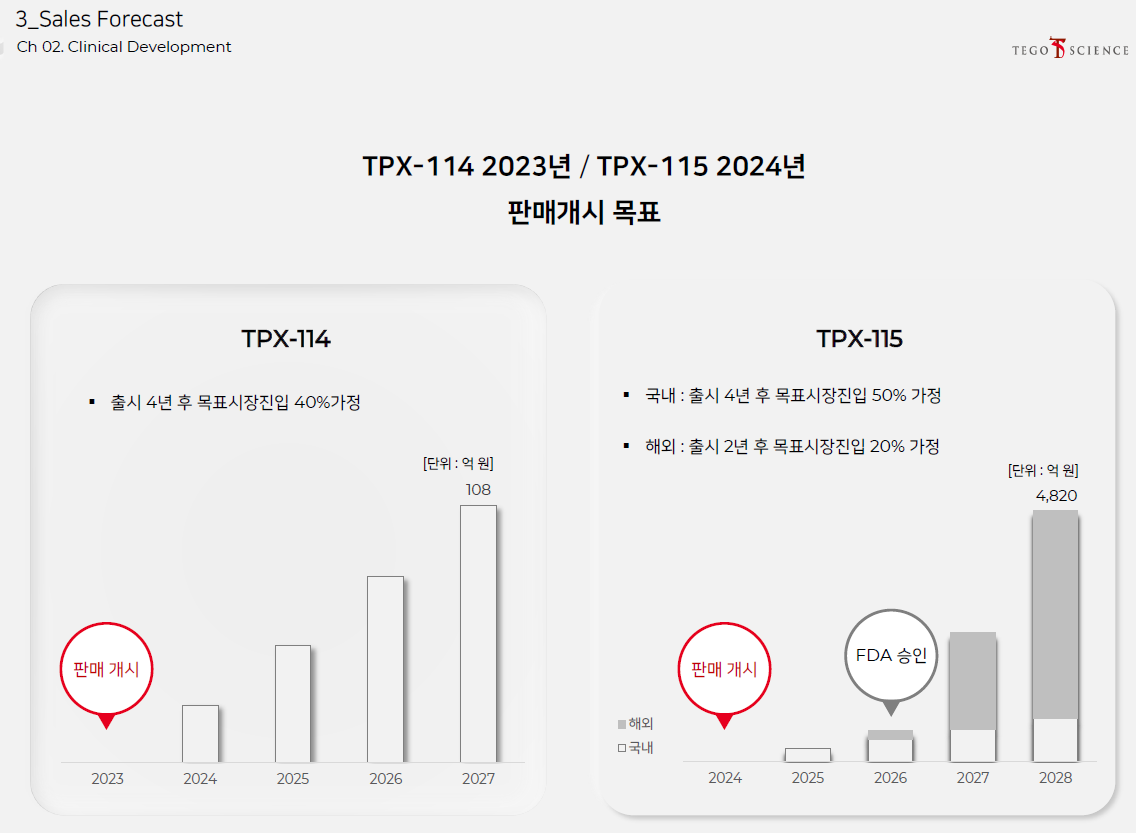
TPX-114는 자가유래기 때문에 광범위한 환자들을 대상으로 쓰려면 동종유래인 TPX-115를 써야 한다. 그렇기 때문에 TPX-115가 훨씬 중요하다.
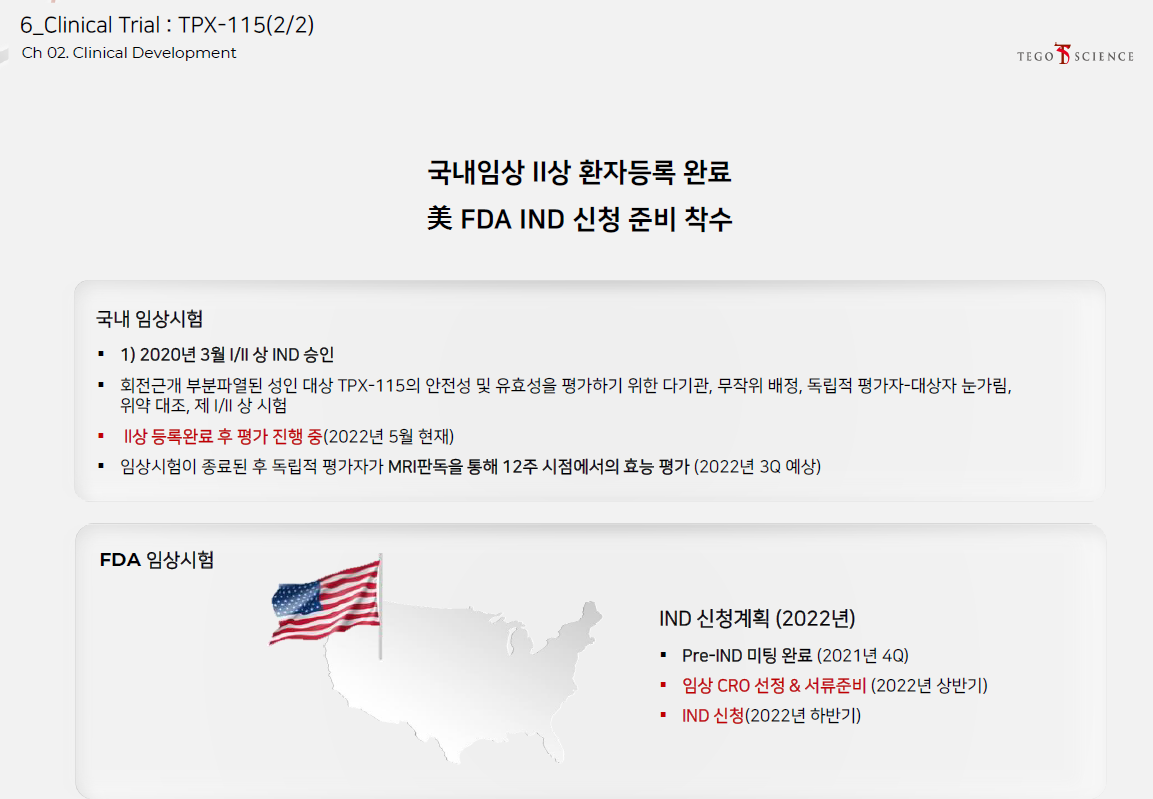
TPX-115는 올해 하반기에 미국 FDA임상을 신청한다. 테고사이언스의 첫 글로벌진출이 되는 셈이다.
당초 올해 상반기였는데 코로나 이슈로 인해 시간이 다소 지연되었다.
주가가 TPX-114 임상3상종료로 인해 상승하였다가 다시 그대로 빠졌다. TPX-114 품목허가 신청과 품목허가 승인 그리고 TPX-115 미국 FDA 임상 신청이 주가의 분기점이 될 것이다.
예상보다 CDMO사업이 부진한 것이 다소 아쉽지만 내년에 출시할 TPX-114의 시장에서의 평가가 테고사이언스의 미래가 걸렸다. 섣부른 투자보다는 일단은 지켜보자.
'주식 > 기업' 카테고리의 다른 글
| #RFHIC, 디시네트워크의 장비 수주 매출 7월부터 발생한다 (0) | 2022.05.29 |
|---|---|
| #쿠콘, 1분기 매출은 분기 최고실적 달성이지만... (0) | 2022.05.25 |
| #테고사이언스, TPX-114 임상1‧3상 종료 (0) | 2022.05.16 |
| #쿠콘, 데이터 전문기관으로 선정될 수 있을까? (0) | 2022.05.06 |
| #인크로스, 1분기 매출하락은 일시적으로 추정 (0) | 2022.04.12 |