알테오젠이 머크에게 키트루다SC임상 3상 진입에 따른 마일스톤을 청구했다.
5월 중으로 170억원이 입금되면 공시가 된다.
알테오젠과 머크는 임상3상 이후 상용화에 대해서도 이미 논의 중이다.
알테오젠 차트를 보면 작년 여름부터 흘러내린 이후 41000원 부근을 뚫지 못하고 있다. 머크 마일스톤 수령이 박스권을 탈출하는 분기점이 되지 않을까 추측해본다.

| 1. 제목 | ALT-B4 관련 마일스톤 기술료 수령 | |
| 2. 주요내용 | ※ 투자유의사항 동 계약은 의약품규제기관의 허가가 완료되어야 이행되는 조건부 계약으로서, 본 계약을 통한 수익 인식은 임상시험과 품목허가 등의 성공 여부에 따라 달라질 수 있습니다. 계약 조건에 따라, 규제기관에 의한 연구ㆍ개발의 중단 품목허가 실패 등 발생시 계약이 해지될 수 있습니다. 1. 기술료 수령 내용 - 대상기술 : 인간 히알루로니다제(ALT-B4) - 계약사항 : 지난 2020.06.24자로 글로벌 10대 제약사에 기술수출한 인간 히알루로니다제(ALT-B4)의 원천기술에 대한 마일스톤 달성 - 기술료 대상금액 : USD13,000,000 (KRW16,840,200,000원) - Invoice 발행일 : 2023-04-03 - 기타 : 기술료는 계약서에 의거하여 당사의 Invoice 발행일로부터 30일 이내 수령할 예정 2. 상기 마일스톤 대금은 $13,000,000(약 168.4억원)으로 전년도 매출액(연결기준 288.0억원)의 100분의 10이상 해당하는 금액으로 의무공시 사항입니다. |
|
| 3. 사실발생(확인)일 | 2023-04-03 | |
| 4. 결정일 | 2023-04-03 | |
| - 사외이사 참석여부 | 참석(명) | - |
| 불참(명) | - | |
| - 감사(사외이사가 아닌 감사위원) 참석여부 | - | |
| 5. 기타 투자판단과 관련한 중요사항 | ||
| 1. 상기 마일스톤 대금은 미화 $13,000,000(약 168.4억원)입니다. (외화환산 적용 기준환율 : \1,295.4/$, 2023.04.03 일자 서울외국환중계 매매기준율) 2. 사실확인일은 계약상대방회사의 마일스톤 통지를 받고 인보이스를 발행한 날짜입니다. 3. 계약상대방회사의 이름과 신약 개발품목 등의 정보는 계약상 영업비밀유지 사항에 속하며 해당 내역은 공시유보사항에 해당합니다. 4. 향후 임상시험, 허가, 상업화 미실현시 라이선스계약은 종료될 수 있으며, 계약 종료에 따른 당사의 계약금, 마일스톤 대금의 반환 의무는 없습니다. 5. 향후 주요 계약내용의 변경 및 관련 공시의무 발생시 당사는 지체없이 공시를 진행할 예정입니다. |
||
| ※ 관련공시 | 2020-06-24 투자판단 관련 주요경영사항(인간 히알루로니다제 원천 기술(ALT-B4) 비독점적 라이센스 계약 체결) |
|
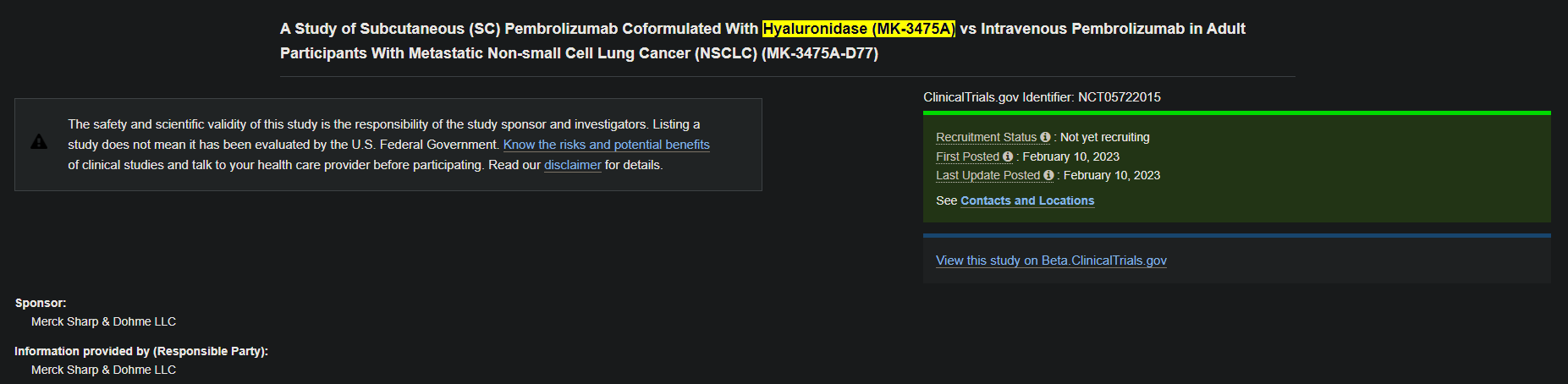
알테오젠, ALT-B4 기술이전 파트너사 임상 3상 진입에 따른 마일스톤 1300만 달러 청구
주주 여러분께,
당사의 ALT-B4 관련 소식 공유해 드립니다.
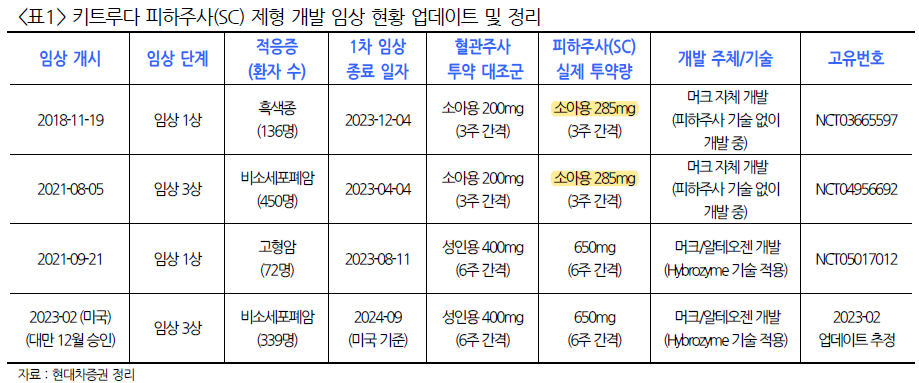
당사가 개발한 재조합 히알루로니다제 ALT-B4 를 활용한 LO 파트너사의 글로벌 임상 3상이 시작되었다는 보도 자료를 지난 2023년 2월 14일자 공지해 드린 이후에 계약 조건에 따라 임상 3상 진입에 따른 마일스톤 대금을 청구하였습니다. 대금 결제 조건은 인보이스(Invoice) 발행 후 30일 입니다. 무엇보다도 당사의 SC제형 변경 플랫폼 기술이 첫 상업화 시기가 가까워졌다는 것이 매우 의미있고 주주 분들과 이를 함께 공유할 수 있어서 또한 기쁘게 생각합니다.
당사는 지금까지 총 4개의 글로벌 기업과 LO 파트너십을 체결하였으며 이번 임상 3상 진입이 ALT-B4 에 대한 기술적 증명과 신뢰도를 제고하는 계기가 될 것으로 기대하고 있습니다. 임상 3상 진입으로 품목허가 단계로 한걸음 더 다가설 것으로 예측되며 피하주사(SC) 제형의 필요성과 효과를 인정한 것이라고 볼 수 있을 것입니다.
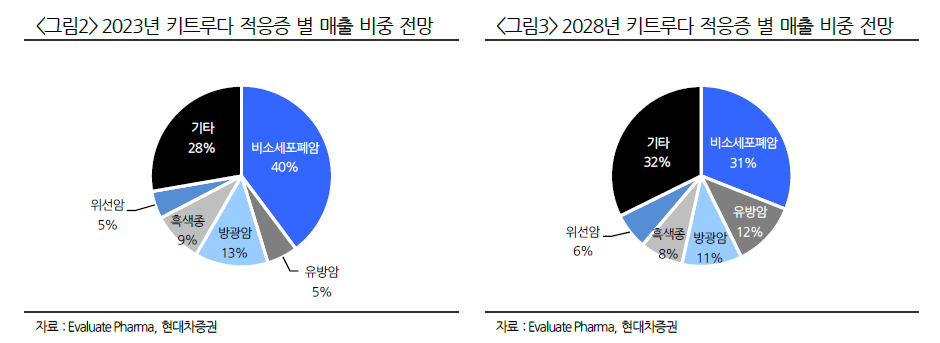
당사의 히알루로니다제를 활용한 SC제형 변경은 기존에 사용된 단일항체치료제(mAb)로 항암 치료 분야에서 자가면역질환 치료 분야로 그 영역이 확대되고 있으며 뿐만 아니라 이중특이성항체(BsAb) 치료제 및 융합단백질(Fusion-protein) 등 적용 분야가 확장되고 있습니다. 향후에는 저분자화합물(Small molecules) 치료제나 항체-약물중합체(ADC) 치료제 등으로 그 적용 분야는 점진적으로 확대될 것으로 기대되고 있습니다.
주주 여러분의 변함없는 관심과 성원 부탁 드립니다. 감사합니다.
'주식 > 알테오젠' 카테고리의 다른 글
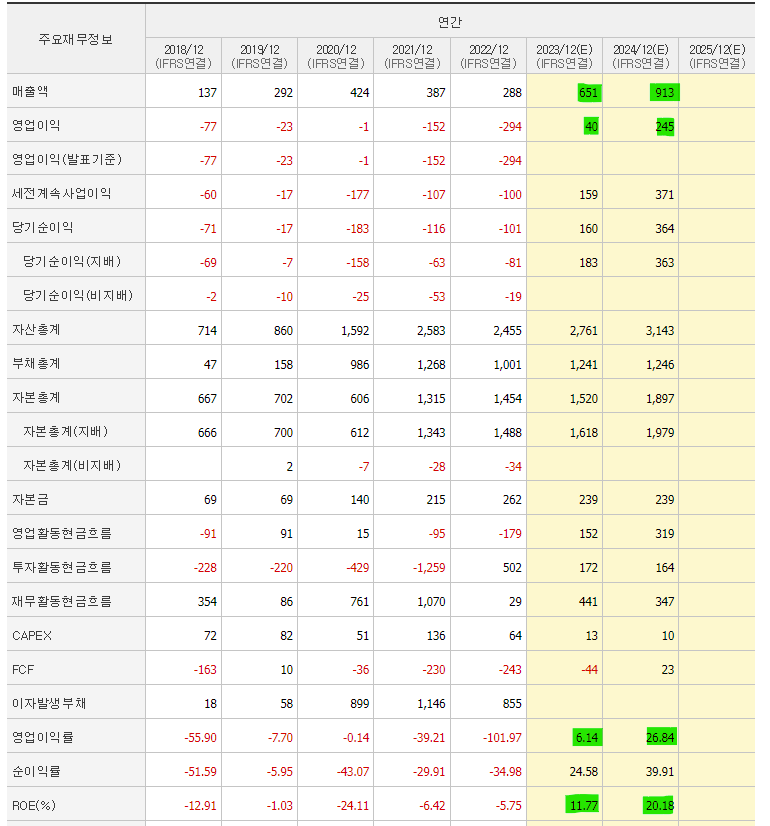
| 알테오젠, 바이오기업인데도 24년 PER 20?? (0) | 2023.04.06 |
|---|---|
| 알테오젠, 사노피에 해외 CMO 확립에 따른 마일스톤 청구! (0) | 2023.04.04 |
| 알테오젠, 바이오시밀러 SC제형은 오직 알테오젠만 가능! (0) | 2023.03.30 |
| 알테오젠, 글로벌 제약사들만 알테오젠의 가치를 제대로 평가하고 있다! (0) | 2023.03.27 |
| 알테오젠, 실적 턴어라운드 기업으로도 좋다! (0) | 2023.03.26 |