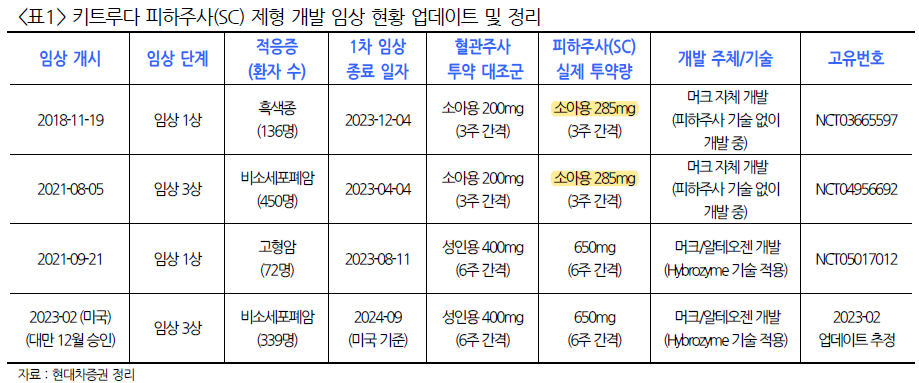
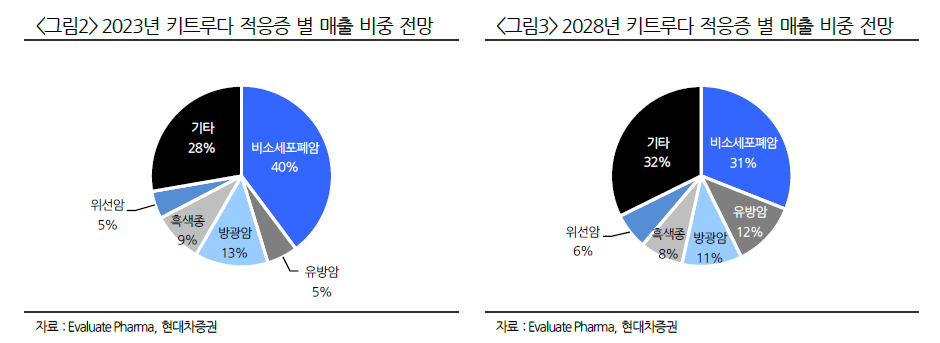
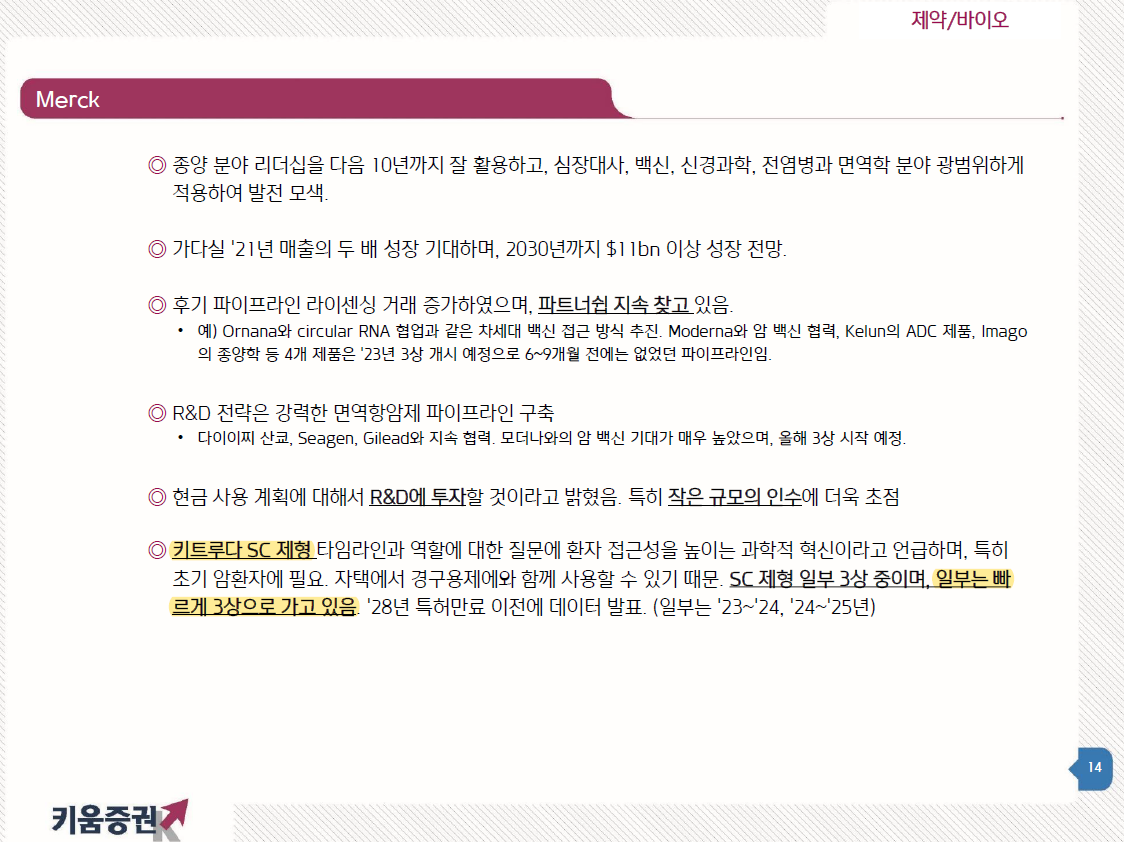
알테오젠의 또다른 파이프라인인 ALT-L9의 임상3상이 1분기에 종료된다.
ALT-L9은 아일리아 바이오시밀러로 타 바이오시밀러 업체 대비 임상은 늦지만 제형/제법/PFS 3가지 특허를 모두 보유하고 있는 장점을 가지고 있다.
알테오젠의 현재 주가에 ALT-L9의 가치는 전혀 반영되지 않았다.
임상3상 종료 후 판권계약도 이제 기대해보자. 판권계약은 삼천당제약처럼 대륙별로 진행할 것으로 예상된다.
ALT-B4에 ALT-L9이 합류한 알테오젠의 가치가 더더욱 기대가 된다.
알테오젠이 올해 상반기 내로 황반변성 치료제 ‘아일리아’의 바이오시밀러 ALT-L9의 임상 종료를 앞두고 있다. 알테오젠은 ALT-L9가 아일리아의 특허를 회피할 수 있도록 개발했다. 회사는 각종 특허를 바탕으로 아일리아 바이오시밀러 시장 1위 등극을 기대하고 있다.
9일 제약바이오 업계에 따르면 알테오젠의 종속회사 알토스바이오로직스는 ALT-L9의 임상 3상을 1분기 내로 종료할 예정이다. 해당 임상은 2021년 12월 체코를 시작으로 한국 등 12개국 450여명을 대상으로 실시 중이다.
미국 리제네론이 개발한 아일리아는 황반변성과 당뇨병성 황반부종 등 치료에 쓰이는 안과질환 치료제다. 2022년 글로벌 매출액은 97억5699만달러(약 12조7000억원)에 달한다.
아일리아는 오는 2025년 11월 유럽에서, 올해 5월에는 미국에서 물질특허가 만료될 예정이다. 다만, 미국의 경우 물질특허 만료 후에도 제형특허가 존재하기 때문에 미국에서는 실질적으로 2027년 6월 이후 아일리아 바이오시밀러 출시가 가능하다. 이에 따라 국내 다수의 기업들도 아일리아 바이오시밀러 출시를 위해 속도를 내고있다.
국내에서는 이미 삼성바이오에피스, 셀트리온, 삼천당제약 등이 제품 임상을 완료하고 글로벌 무대에서 품목허가 절차를 밟고 있다. 알테오젠은 아직 임상 3상을 진행 중으로 개발 속도 측면에서는 다소 늦었지만 오리지널 제품 아일리아의 특허 만료 시점에 맞춰 품목허가 및 출시해 경쟁에 뛰어들 전망이다.
알테오젠 관계자는 “1분기 내로 임상 3상의 주요 데이터가 나올 예정이며 상반기 내로는 최종 임상 결과를 도출할 것으로 예상된다”며 “현재 임상 진행 속도에 따르면 유럽시장 특허가 풀리는 2025년과 미국시장 2027년 출시를 맞추는 것은 어렵지 않을 것”이라고 말했다.
알테오젠은 아일리아 바이오시밀러 개발 속도는 늦었지만 글로벌 진출 속도와 점유율 확대에서 만큼은 누구보다 빠를 것으로 자신하고 있다.
알테오젠의 자신감은 오리지널 제품인 아일리아를 뛰어넘는 각종 특허에서 나온다. 알테오젠은 아일리아 바이오시밀러 개발 관련 제형과 프리필드시린지(PFS, 사전충전주사)에 이어 제법 특허 등 3가지 특허를 모두 확보했다.
먼저 제형 특허와 관련해 항체의약품인 아일리아는 항체 외에도 약물의 양을 맞추기 위한 버퍼(Buffer)가 필요한데 알테오젠은 독자적인 기술을 확보하고 있다. 아일리아가 보유한 특허와 무관하게 개발이 자유롭다는 의미다.
알테오젠 관계자는 “지난 2022년 리제레논이 비아트리스에 제기한 특허 침해 소송이 이 제형과 관련된 부분”이라며 “독자적 제형 기술로 다른 시밀러 제품과 차별성을 뒀다”고 설명했다.
아울러 최근 아일리아의 매출 75% 가량이 PFS 제형에서 나오고 있는 만큼 알테오젠도 관련 기술을 선제적으로 개발, 특허 출원해 등록 국가를 확대 중이다.
특히, 아일리아의 프리필드시린지 제형은 유리 주사기에 충전하는 형태지만, 알테오젠은 플라스틱을 사용했다. 플라스틱 용기는 유리 제품과 다르게 실리콘 오일을 사용하지 않기 때문에 이로 인해 발생하는 부작용도 줄일 것으로 예상된다.
마지막으로 알테오젠은 제법 특허를 통해 가격 경쟁력도 확보했다. 알테오젠은 2022년말 유럽 특허청으로부터 ALT-L9의 배양공정에 대한 특허를 획득했다. 유럽에서의 특허 등록은 한국과 러시아, 호주, 일본, 중국, 미국에 이어 7번째로 이뤄졌다.
해당 특허는 아일리아 바이오시밀러 제조과정에서 필수적인 배양방법이 담겨 있으며 이를 활용하면 생산성 높은 제품을 제조할 수 있다. 바이오시밀러는 오리지널 제품 대비 저렴하다는 점이 가장 큰 장점이다. ALT-L9는 동종의 바이오시밀러 중에서도 높은 생산성을 통해 가격경쟁력을 확보했다.
알테오젠 관계자는 “바이오시밀러 시장에서 가격 경쟁력은 무엇보다 중요하다”라며 “해당 특허는 생산성과 직접적으로 연관돼 있기 때문에 경쟁사들의 특허 침해 여부도 지속적으로 살펴볼 것”이라고 강조했다.
한편, 업계는 황반변성 치료제 시장 규모가 지난 2022년 105억2000만달러(약 14조원)에서 2030년 179억달러(약 23조원) 로 성장할 것으로 전망한다.
https://www.edaily.co.kr/news/read?newsId=03020886638756408&mediaCodeNo=257&OutLnkChk=Y
알테오젠, 곧 ALT-L9 임상 종료…바이오시밀러 1등 노린다
알테오젠(196170)이 올해 상반기 내로 황반변성 치료제 ‘아일리아’의 바이오시밀러 ALT-L9의 임상 종료를 앞두고 있다. 알테오젠은 ALT-L9가 아일리아의 특허를 회피할 수 있도록 개발했다. 회사는
www.edaily.co.kr
'주식 > 알테오젠' 카테고리의 다른 글
| 알테오젠, 머크는 키트루다SC 임상3상 성공을 확신하고 있다! (0) | 2024.01.19 |
|---|---|
| 알테오젠, 테르가제/키트루다SC/아일리아 바이오시밀러 순항중! (0) | 2024.01.13 |
| 알테오젠, 테르가제 출시는 24년 상반기 예상! (1) | 2023.12.06 |
| 알테오젠, 연말선물로 머크와의 독점계약+추가 L/O를 기대해보자! (3) | 2023.11.27 |
| 알테오젠, 정혜신 지분 지금 팔 이유 없다! (0) | 2023.11.20 |